
【题目】某同学仰视量筒中液体,读其体积为m mL,倒出少许后俯视读数为n mL,则倒出的液体体积
A.小于(m-n)mLB.大于(m-n)mL
C.等于(m-n)mLD.大于或等于(m-n)mL
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】用下面两种方法可以制得白色的Fe(OH)2沉淀:
【方法一】用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应来制备。
实验室用硫酸亚铁晶体配制上述FeSO4溶液时,一般需加入铁粉和稀硫酸,加入铁粉的目的是_____________。
【方法二】在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂来制备。

(1)实验开始时,止水夹e是______(填“打开”或“关闭”)的。
(2)如何检验装置内空气已经排尽?________________。
(3)排尽装置内空气后,为了制得白色Fe(OH)2沉淀,操作步骤是________。
(4)开启活塞f放掉约2/3液体,此时裝置B中试剂瓶中发生的化学反应方程式为________。
(5)下列各图示中________(填序号)能较长时间看到Fe(OH)2白色沉淀。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应aFeCl2+bKNO3+cHCl=- dFeCl3+eKCl+fX+gH2O中,其中a,b,c,d,e,f,g均为相应的物质系数,若b=l.d=3,则生成物X的分子式为
A. NO2 B. NO C. N2O D. NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据要求填空:
(1) 用系统命名法命名:
用系统命名法命名:
(2)![]() 官能团的名称是
官能团的名称是
(3)分别完全燃烧1molC2H6、1molC2H4、1molC2H2 , 需要氧气最多的是 .
(4)![]() 的分子式为
的分子式为
(5)1mol某不饱和烃可以和1molCl2发生加成反应,生成2﹣甲基﹣2,3﹣二氯戊烷,则该不饱和烃是(写结构简式)
(6)某有机物的分子式为C4H4 , 它有一种同分异构体,每个碳原子均达到饱和,且碳与碳的夹角相同,该分子中碳原子形成的空间构型为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石主要含Cu2(OH)2CO3 , 以及少量Fe、Si的化合物.可以用孔雀石为原料制备胆矾(CuSO45H2O),步骤如图: 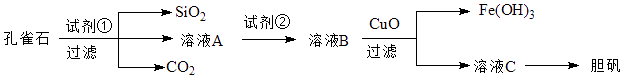
请回答下列问题:
(1)试剂①是一种常见的酸,写出其化学式 . 过滤所需要的玻璃仪器有
(2)实验室检验Fe3+的常用方法是 .
(3)溶液A中的金属离子有Cu2+、Fe2+、Fe3+ , 上述流程中需要用试剂②将溶液A中的Fe2+全部转化为Fe3+ , 从而形成溶液B,则试剂②能否用氯水(填“能”或“不能”,若“不能”,请解释原因).
(4)由溶液C获得胆矾,需要经过、、过滤等操作.
(5)取25.00mL溶液A,用1.000×10﹣2mol/LKMnO4标准溶液滴定.反应离子方程式为:5Fe2++MnO4﹣+8H+→5Fe3++Mn2++4H2O,若消耗标准溶液20.00mL,则溶液A中Fe2+的浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)n(B)的变化关系.则下列结论正确的是( ) 
A.200℃时,反应从开始到平衡的平均速率v(B)=0.04molL﹣1min﹣1
B.图Ⅱ所知反应xA(g)+yB(g)zC(g)的△H<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl26H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3 , 还含少量Fe2O3、Al2O3、MnO等)制取CoCl26H2O的工艺流程如图1: 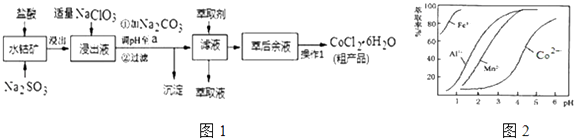
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl26H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式 .
(2)写出NaClO3发生反应的主要离子方程式;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式 .
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为 .
(4)制得的CoCl26H2O在烘干时需减压烘干的原因是 .
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是;其使用的最佳pH范围是 . A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl26H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl26H2O的质量分数大于100%,其原因可能是 . (答一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式或离子方程式正确的是( )
A.乙酸与碳酸钠溶液反应的离子方程式:2H++CO32﹣═CO2↑+H2O
B.乙醇与浓硫酸在140℃时共热:CH3CH2OH ![]() CH2═CH2↑+H2O
CH2═CH2↑+H2O
C.丙烯聚合成聚丙烯的化学方程式:nCH2=CHCH3 ![]()
![]()
D.用18O标记的乙醇与乙酸发生酯化反应:C2H518OH+CH3COOH ![]() CH3CO18OC2H5+H2O
CH3CO18OC2H5+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,利用CO2合成CH3OH的反应如下: CO2(g)+3H2(g)H3OH(g)+H2O(g)△H1 ,
研究发现,反应过程中会有副反应:
CO2(g)+H2(g)CO(g)+H2O(g)△H2 .
温度对CH3OH、CO的产率影响如图所示.下列说法中,不正确的是( )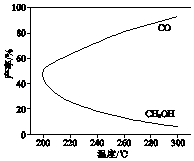
A.△H1<0,△H2>0
B.增大压强有利于加快合成反应的速率
C.生产过程中,温度越高越有利于提高CH3OH的产率
D.合成CH3OH反应的平衡常数表达式是K= ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com