
【题目】煤的气化是对煤进行深加工的重要方法,其主要反应是碳和水蒸气反应生成水煤气。
(1)已知在101KPa、150℃时,各1mol的碳、一氧化碳和氢气在足量的氧气充分燃烧并恢复至原温度,所放出的热量分别为393.7kJ/mol、283.0kJ/mol、242.0 kJ/mol,请写出煤的气化反应的热化学方程式__________________;请从热力学角度简述该反应在某条件下能够正向进行的原因是_______________。
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是_________。(填序号)
A.正反应速率先增大后减少 B.化学平衡常数K减少
C.混合气体的平均相对分子质量减少 D.反应物气体体积分数增大
(3)一定条件下煤的气化产物还可以发生反应,700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:
CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:
反应时间/ min | n(CO)/ mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
5 | 0.80 | |
10 | 0.20 |
请根据表格回答下列问题:
①计算反应在5min内由氢气表示的平均速率为:_____________。
②列式并计算该反应在700℃时的化学平衡常数K=__________,如果温度升至800℃,上述反应平衡常数为0.64,则正反应为___________(填“吸热”或“放热”)反应。
③将上表中达平衡后的混合气体恢复至室温,用200mL2mol/LNaOH溶液进行吸收,充分反应后假设溶液体积不变,下列说法不正确的是:(已知HCO3-电离常数约为4![]() 10-11,CaCO3的溶度积常数约为3
10-11,CaCO3的溶度积常数约为3![]() 10-9)___________
10-9)___________
A.c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
B.c(H2CO3)<c(CO32-)
C.c(Na+)+c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D.向该溶液中加入等体积等浓度的CaCl2溶液产生白色沉淀
【答案】 C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3kJ/mol 该反应的正向混乱度增大或正反应是熵增的反应 AC v(H2)=0.04 mol·L-1·min-1 K=c(CO2)c(H2)/c(CO)c(H2O)=1 放热 B
【解析】(1)根据题意写出热化学方程式,①C(s)+O2(g)=CO2(g)![]() H=-393.7 kJ/mol,②CO(g)+
H=-393.7 kJ/mol,②CO(g)+![]() O2(g)=CO2(g)
O2(g)=CO2(g)![]() H=-283.0 kJ/mol,③H2(g)+
H=-283.0 kJ/mol,③H2(g)+![]() O2(g)=H2O(g)
O2(g)=H2O(g)![]() H=-242.0 kJ/mol,根据盖斯定律,①-②-③得:C(s)+H2O(g)=CO(g)+H2(g)
H=-242.0 kJ/mol,根据盖斯定律,①-②-③得:C(s)+H2O(g)=CO(g)+H2(g)![]() H=+131.5 kJ/mol,。因为该反应
H=+131.5 kJ/mol,。因为该反应![]() H>0、
H>0、![]() S>0,根据化学反应方向的判据:
S>0,根据化学反应方向的判据:![]() HT
HT![]() S可得,在高温下
S可得,在高温下![]() HT
HT![]() S可能小于0,能够正向进行。故答案为:C(s)+H2O(g)=CO(g)+H2(g)
S可能小于0,能够正向进行。故答案为:C(s)+H2O(g)=CO(g)+H2(g)![]() H=+131.5 kJ/mol;该反应的正向混乱度增大或正反应是熵增的反应 。
H=+131.5 kJ/mol;该反应的正向混乱度增大或正反应是熵增的反应 。
(2)A项,当改变某一条件时,正反应速率先增大后减小,说明开始时平衡逆向移动,后来平衡正向移动,反应物浓度降低导致正反应速率减小,故A项正确;B项,化学平衡常数K减少,反应程度减小,所以平衡逆向移动,故B项错误;C项,正反应是气体分子数增大的反应,所以混合气体的平均相对分子质量减少说明气体分子数增大,平衡正向移动,故C项正确;D项,反应物气体体积分数增大,说明平衡逆向移动,故D项错误。综上所述,符合题意的选项为AC。
(3)①根据用不同物质表示的化学反应速率之比=化学方程式计量数之比,5min内用氢气表示的平均速率:v(H2)=v(CO)=(1.200.80)mol÷2L÷5min=0.04 mol·L-1·min-1 ;②由化学方程式,根据已知条件可得,5min时反应已达平衡,列三段式:
CO(g)+H2O(g)![]() CO2(g)+ H2(g)
CO2(g)+ H2(g)
开始( mol·L-1) 0.60 0.30 0 0
转化( mol·L-1) 0.20 0.20 0.20 0.20
平衡( mol·L-1) 0.40 0.10 0.20 0.20
K=![]() =
=![]() =1;因为温度升至800℃,平衡常数为0.64<1,所以升温,化学平衡逆向移动,正反应为放热反应。③由题意CO2为0.4mol,NaOH为0.4mol,所以恰好反应生成0.4mol NaHCO3,根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故A项正确;B项,根据HCO3-水解常数Kh=Kw/Ka=
=1;因为温度升至800℃,平衡常数为0.64<1,所以升温,化学平衡逆向移动,正反应为放热反应。③由题意CO2为0.4mol,NaOH为0.4mol,所以恰好反应生成0.4mol NaHCO3,根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故A项正确;B项,根据HCO3-水解常数Kh=Kw/Ka=![]() >Ka,所以HCO3-水解程度大于电离程度,因此c(H2CO3)>c(CO32-),故B项错误;C项,由物料守恒:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-)和电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)可得:c(Na+)+c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故C项正确;D项,由已知可得,向该溶液中加入等体积等浓度的CaCl2溶液时,c(Ca2+)=1 mol/L,c(HCO3-)=1mol/L,根据HCO3-
>Ka,所以HCO3-水解程度大于电离程度,因此c(H2CO3)>c(CO32-),故B项错误;C项,由物料守恒:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-)和电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)可得:c(Na+)+c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故C项正确;D项,由已知可得,向该溶液中加入等体积等浓度的CaCl2溶液时,c(Ca2+)=1 mol/L,c(HCO3-)=1mol/L,根据HCO3-![]() H++CO32-,可得Ka(HCO3-)=
H++CO32-,可得Ka(HCO3-)=![]() =
=![]() =4×10-11,因此c2(CO32-)=4×10-11,所以c(CO32-)×c(Ca2+)=
=4×10-11,因此c2(CO32-)=4×10-11,所以c(CO32-)×c(Ca2+)=![]() >Ksp(CaCO3)=3×10-9,有白色沉淀析出,故D项正确。综上所述,符合题意的选项为B。
>Ksp(CaCO3)=3×10-9,有白色沉淀析出,故D项正确。综上所述,符合题意的选项为B。


科目:高中化学 来源: 题型:
【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
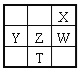
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
D. YX2晶体熔化、液态WX3气化均需克服分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A. B之间存在转化关系:A(C6H12O2) +H2O![]() B+HCOOH(已配平)则符合该反应条件的有机物B有(不含立体异构)
B+HCOOH(已配平)则符合该反应条件的有机物B有(不含立体异构)
A. 6种 B. 7种 C. 8种 D. 9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年12月1日,华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2 ![]() C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确的是
C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确的是

A. 该电池若用隔膜可选用质子交换膜
B. 放电时,LiCoO2极发生的电极反应为:LiCoO2-xe-= Li1-xCoO2+xLi+
C. 石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
D. 废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程中,ΔS<0的是 ( )
A.氯化钠溶于水中 B.NH3(g)和HCl(g)反应生成NH4Cl(s)
C.干冰的升华 D.CaCO3(s)分解为CaO(s)和CO2(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、SO42﹣及泥沙,可将粗盐溶于水,然后进行下列五项操作.其中正确的是①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过BaCl2溶液( )
A.①④②⑤③
B.④①②⑤③
C.②⑤④①③
D.②④①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.纯碱(Na2CO3)从物质的分类看不属于碱
B.由一种元素组成的物质一定是单质
C.凡是能电离出H+的化合物均属于酸
D.盐类物质一定含有金属离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的密闭容器中存在如下反应:A(g)+B(g)![]() C(g)+D(g),已知A和B的起始浓度均为3mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
C(g)+D(g),已知A和B的起始浓度均为3mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
(1)达到平衡时,A的转化率为多少?(3分)
(2)当A的起始浓度仍为3mol·L-1,B的起始浓度为6mol·L-1,求:平衡时A的体积分数?(3分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com