
【题目】下列物质属于化合物的是( )
A. 油脂 B. 蛋白质 C. 漂白粉 D. 酒精
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是( )
A. 1 mol NH5中含有5 NA个N﹣H键(NA表示阿伏加德罗常数)
B. NH5中既有共价键又有离子键
C. NH5的电子式为![]()
D. 它与水反应的离子方程式为NH4++H﹣+H2O=NH3H2O+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:2NO+2CO![]() 2CO2+N2。
2CO2+N2。
(1)写出CO2的结构式____________,N2的电子式___________。
(2)一定条件下,在容积固定的容器中进行上述反应,CO浓度与时间关系如图所示:
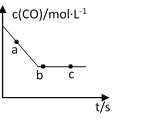
①则反应速率υ(a)、υ(b)、 υ(c)的大小关系是______________;
②下列可说明反应到达图中c点的是__________;
A.NO、CO、CO2、N2表示的速率比值保持2︰2︰2︰1不变
B.CO的浓度不再改变
C.反应消耗2molNO的同时消耗1molN2
D.容器中的气体质量或物质的量保持不变
(3)为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
【资料查阅】
A.不同的催化剂对同一反应的催化效率不同;
B.使用等质量相同的催化剂时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积 m2/g | 达平衡时所用的时间min |
Ⅰ | 参照实验 | 280 | 6.50×10-3 | 4.00×10-3 | 80 | t |
Ⅱ | 280 | 6.50×10-3 | 4.00×10-3 | 120 | 0.5t | |
Ⅲ | 360 | 6.50×10-3 | 4.00×10-3 | 80 | 0.2t |
【结论】①实验编号Ⅱ的实验目的为_________________________。
②课题中探究外界条件对汽车尾气转化反应速率的影响的另一因素是___________,且____________反应速率将___________。(填“增大”、“减小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+3B=2C+2D在四种不同情况下的反应速率分别为:
①v(A)=0.15mol/(L·s)②v(B)=0.6mol/(L·s)
③v(C)=0.4 mol/(L·s)④v(D)=0.45 mol/(L·s)
该反应进行的快慢顺序为( )
A.④>③=②>① B.④<③=②<①
C.①>②>③>④ D.④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯气的叙述正确的是( )
A.钠在氯气中燃烧产生白色烟雾
B.红热的铜丝在氯气中燃烧生成CuCl
C.纯净的氢气可以在氯气中安静地燃烧,发出黄色火焰
D.向田鼠洞里通入氯气杀灭田鼠,利用了氯气有毒和密度较大的性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化是对煤进行深加工的重要方法,其主要反应是碳和水蒸气反应生成水煤气。
(1)已知在101KPa、150℃时,各1mol的碳、一氧化碳和氢气在足量的氧气充分燃烧并恢复至原温度,所放出的热量分别为393.7kJ/mol、283.0kJ/mol、242.0 kJ/mol,请写出煤的气化反应的热化学方程式__________________;请从热力学角度简述该反应在某条件下能够正向进行的原因是_______________。
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是_________。(填序号)
A.正反应速率先增大后减少 B.化学平衡常数K减少
C.混合气体的平均相对分子质量减少 D.反应物气体体积分数增大
(3)一定条件下煤的气化产物还可以发生反应,700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:
CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:
反应时间/ min | n(CO)/ mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
5 | 0.80 | |
10 | 0.20 |
请根据表格回答下列问题:
①计算反应在5min内由氢气表示的平均速率为:_____________。
②列式并计算该反应在700℃时的化学平衡常数K=__________,如果温度升至800℃,上述反应平衡常数为0.64,则正反应为___________(填“吸热”或“放热”)反应。
③将上表中达平衡后的混合气体恢复至室温,用200mL2mol/LNaOH溶液进行吸收,充分反应后假设溶液体积不变,下列说法不正确的是:(已知HCO3-电离常数约为4![]() 10-11,CaCO3的溶度积常数约为3
10-11,CaCO3的溶度积常数约为3![]() 10-9)___________
10-9)___________
A.c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
B.c(H2CO3)<c(CO32-)
C.c(Na+)+c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D.向该溶液中加入等体积等浓度的CaCl2溶液产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种主族元素的单质在常温下都是常见的无色气体,在适当条件下,三者之间可以两两发生反应生成分别是双核、三核和四核的甲、乙、丙三种分子,且乙、丙分子中含有X元素的原子个数比为2∶3。请回答下列问题:
(1)元素X的名称是________,丙分子的电子式为________。
(2)若甲与Y单质在常温下混合就有明显现象,则甲的化学式为________。丙在一定条件下转化为甲和乙的反应方程式为___________________________。
(3)化合物丁含X、Y、Z三种元素,丁是一种常见的强酸,将丁与丙按物质的量之比1∶1混合后所得物质戊的晶体结构中含有的化学键为________(选填序号)。
a.只含共价键 b.只含离子键 c.既含离子键,又含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作正确的是( )
A. 取下的分液漏斗的玻璃塞倒放在桌面上 B. 洗净的量筒放在烘箱中烘干
C. 用pH试纸测定浓硫酸的pH D. 过滤时,漏斗的尖嘴紧靠烧杯内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以对羟基苯甲醛为原料,合成降血脂药物环丙贝特的流程图如下:

已知: 
请回答下列问题:
(1)下列说法不正确的是___________。
A.环丙贝特分子中存在2个手性碳原子 B. D的分子式为C14H16Cl2O3
C.C中含有的官能团有醚键、酯基和碳碳双键 D.反应②③⑤均为取代反应
(2)B的结构简式为____________ 。
(3)写出A与足量溴水反应的化学方程式为____________ 。
(4)请写出符合下列条件的A的所有同分异构体的结构简式____________ 。
i分子中含有苯环,不含其他环状结构
ii 1H-NMR谱显示共有4个峰
(5)已知:①
②苯环上有甲基时,新取代基主要取代在邻位或对位,有醛基时主要取代在间位。请写出以甲苯为原料合成![]() 的流程图,其他无机原料任选。__________________
的流程图,其他无机原料任选。__________________
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com