
����Ŀ����ɫ����N2O4��һ��ǿ��������Ϊ��Ҫ�Ļ���ƽ���֮һ��N2O4��NO2֮����ڷ�Ӧ:N2O4(g)![]() 2NO2 (g) ��H=+57.2 kJ/mol��
2NO2 (g) ��H=+57.2 kJ/mol��
(1)��һ����N2O4���뵽���º��ݵ��ܱ������С�
����˵���÷�Ӧ�ﵽƽ��״̬����____
a.v��(N2O4)=2v��(NO2)
b.������������¶Ȳ���
c.����������ƽ����Է�����������
d.��������ܶȲ���
�ڴﵽƽ��״̬����������������¶�,�ٴε���ƽ��״̬ʱ���������ɫ_______(����������dz�����䡱)�� �ж�����___________��
(2)��һ����N2O4���뵽���º�ѹ���ܱ�������(�¶�298K��ѹǿ100kPa)���÷�Ӧ�У�����Ӧ����v��=k����p(N2O4),�淴Ӧ����v��=k����p2(NO2),����k����k��Ϊ���ʳ���,pΪ��ѹ(��ѹ=��ѹ�����ʵ�������)����÷�Ӧ��ѹǿƽ�ⳣ��Kp=_____(��k����k����ʾ)������������k��=4.4��104s-1,��N2O4�ֽ�10%ʱ��v��=____kPa��s-1
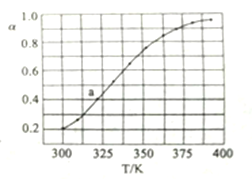
(3)��һ����N2O4���뵽�����ܱ������С���ò�ͬ�¶���,N2O4��ƽ��ת����a��ͼ��ʾ����֪N2O4����ʼѹǿp0Ϊ210kPa,����ͼ��a���Ӧ�¶��·�Ӧ��ѹǿƽ�ⳣ��Kp=______��
���𰸡� c ���� �÷�Ӧ����Ϊ���ȷ�Ӧ,����ʹƽ�������ƶ�,c(NO2)����������ɫ���� k��/k�� 3.6��106 224 kPa
����������1����a.v��(N2O4)=2v��(NO2)���������淴Ӧ������ȣ���Ӧû�дﵽƽ��״̬��a����b.�����Ǻ��º��ݣ�����������������¶Ȳ���������˵���÷�Ӧ�ﵽƽ��״̬��b������c.�������ƽ����Է��������ǻ�����������ͻ�������ܵ����ʵ����ı�ֵ���������䣬�����ʵ����DZ仯�ģ���������������ƽ����Է�����������˵���÷�Ӧ�ﵽƽ��״̬��c��ȷ��d.�ܶ��ǻ�����������������ݻ��ı�ֵ���ڷ�Ӧ�������������ݻ�ʼ���Dz���ģ����Ի�������ܶȲ���������˵���÷�Ӧ�ﵽƽ��״̬��d����ѡc���ڴﵽƽ��״̬����������������¶ȣ�����Ӧ���ȣ�ƽ��������Ӧ������У�NO2Ũ�������ٴε���ƽ��״̬ʱ���������ɫ�����2��ƽ��ʱ����������ȣ�����v��=k����p(N2O4)��v��=k����p2(NO2)�������ɵ�Kp=K��/K������N2O4�ֽ�10%ʱ����Ͷ���N2O4Ϊ1mol��ת����N2O4Ϊ0.1mol������ݷ���ʽ��֪
N2O4��g��![]() 2NO2��g�� ���ʵ��������n
2NO2��g�� ���ʵ��������n
1mol 2mol��1mol=1mol
0.1mol 0.1mol
�ʴ�ʱp��N2O4��=![]() ����v��=4.4��l04s-1��
����v��=4.4��l04s-1��![]() =3.6��106 kPas-1����3����N2O4����ʼ����1mol��a��ת������0.4������ݷ���ʽ��֪
=3.6��106 kPas-1����3����N2O4����ʼ����1mol��a��ת������0.4������ݷ���ʽ��֪
N2O4��g��![]() 2NO2��g��
2NO2��g��
��ʼ����mol�� 1 0
ת������mol�� 0.4 0.8
ƽ������mol�� 0.6 0.8
����ƽ����ѹǿ��1.4��210kPa��294 kPa������a���Ӧ�¶��·�Ӧ��ѹǿƽ�ⳣ��Kp= ��
��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϸ���ںϳ�ø��ԭ������ ��
A�����Ǻ����� B������������
C�������� D�������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ѧ��������A��B��C��D��E��X,������ͼת����ϵ(����������ͷ�Ӧ��������ȥ)�������ƶϴ������
![]()
A. ��DΪNaCl,��A����C��Ӧ����B,��E������CO2
B. ��D��һ�ְ�ɫ�������ڿ��������ձ�Ϊ���ɫ����A��������
C. ��D��һ��ǿ���A.B.C������X��Ӧ����D
D. ��D��һ��ǿ�ᣬ��A �ȿ��ǵ���Ҳ���ǻ������D ����ͭ��Ӧ����B��C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ�ģ� ��
A.���ֽⷴӦ������������ԭ��ӦB.�û���Ӧһ����������ԭ��Ӧ
C.���Ϸ�Ӧ����������ԭ��ӦD.������ԭ��Ӧ��һ������Ԫ�زμ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п���仯����������������Ӧ�ñȽϹ㷺��
(1)ZnFe2O4��һ���������������Ų���,Ҳ��һ�ִ������ܴ�ϩ���л�����������ȷ�Ӧ��
��ZnFe2O4��Fe�Ļ��ϼ���___________��
�ڹ�ҵ�����÷�ӦZnFe2(C2O4)3��6H2O![]() ZnFe2O4+2CO2��+4CO��+6H2O �Ʊ�ZnFe2O4�÷�Ӧ�л�ԭ������___(�ѧʽ),ÿ����1mol ZnFe2O4ת�Ƶĵ���������__________��
ZnFe2O4+2CO2��+4CO��+6H2O �Ʊ�ZnFe2O4�÷�Ӧ�л�ԭ������___(�ѧʽ),ÿ����1mol ZnFe2O4ת�Ƶĵ���������__________��
(2)��ҵ������п��ɰ(��Ҫ��ZnO��ZnFe2O4������������FeO��CuO������)��ȡ����п�Ĺ�����������:
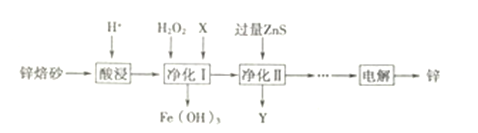
�����ʱҪ��п��ɰ����,��Ŀ����������Ч��,Ϊ�ﵽ��һĿ��,���ɲ��õĴ�ʩ��_______(�δ�һ��)��д��ZnFe2O4����������ӷ���ʽ__________��
�ھ���I��H2O2 ���뷴Ӧ�����ӷ���ʽΪ___________
�۾�������Y ����Ҫ�ɷ���_____(�ѧʽ)��
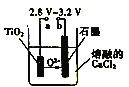
(3)����п�̵����800~1000��ʱ���TiO2���Ƶý����ѣ�װ����ͼ��ʾ��ͼ��a�缫�IJ���Ϊ_____�������ĵ缫��ӦʽΪ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ��������������ԭ�������Ĺ�ϵͼ�� 
��ش��������⣺
��1������Z��ԭ�ӽṹʾ��ͼ ��
��2��ԭ�Ӱ뾶��YZ�������������������
��3��Y������������ˮ����������������Һ��Ӧ�Ļ�ѧ����ʽΪ ��
��4��X������������ˮ����Ļ�ѧʽΪ ��
��5������W���⻯��ĵ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һʵ����˵����Ԫ����������������
A. Mg��Ҷ���ز���ȱ�ٵ���ɳɷ�
B. �Ͳ�ȱ��Bʱֻ���������
C. P��ϸ��Ĥ����ȱ�ٵ���ɳɷ�
D. ��������Ԫ�غ����ܸ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ����գ�
��1����ϩ�IJ�������Ϊ�ı�־��д����ϩ��һ����; ��
��2��д���߷��� 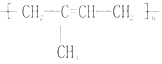 ������ �� �䵥��Ľṹ��ʽ ��
������ �� �䵥��Ľṹ��ʽ ��
��3�������ж���ͬ���칹�壬����һ��ͬ���칹�岻����ϩ���ӳɵõ���д������ͬ���칹��ṹ��ʽ ��
��4���л���C8H8��һ��ͬ���칹��1H����NMR����ֻ��һ���źţ�����ʹ��ˮ��ɫ��д����ṹ��ʽ ��
��5���л���C7H15Br��һ��ͬ���칹�����������Ƶ��Ҵ���Һ���ȿɵõ�����ϩ����д������ͬ���칹��Ľṹ��ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ��ϸ���У������ڵĺ�������Ҫ��ָ
A. DNA B. RNA C. ������ D. �����ʺͺ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com