
【题目】活细胞内合成酶的原料是( )
A.核糖核苷酸 B.脱氧核苷酸
C.氨基酸 D.氨基酸或核糖核苷酸
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为短周期元素,在周期表中所处的位置如下图所示。A、C两种元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等:
A | C | |
D | B | E |
(1)写出三种元素名称A________、B _______、C_______。
(2)B元素位于元素周期表中第______周期,_______族。
(3)比较B、D、E三种元素的最高价氧化物的水化物酸性最强的是(用化学式表示)______。
(4)C原子结构示意图为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保护环境、保护地球已成为人类共同的呼声。下列措施不利于环境保护的是( )
A.推广使用无铅汽油
B.提倡使用太阳能
C.推广使用无磷洗衣粉
D.提倡个人使用大批量汽车
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年8月5日在巴西里约召开的第31届奥运会,由于兴奋剂事件而使多名俄罗斯运动员遭到禁赛,禁止运动员使用兴奋剂是奥运会公平、公正的重要举措之一.以下有两种兴奋剂的结构分别为: 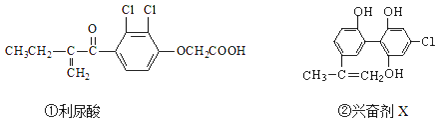
则关于以上两种兴奋剂的说法中不正确的是( )
A.利尿酸能发生取代反应、加成反应和酯化反应
B.1mol兴奋剂X与足量浓溴水反应,最多消耗3molBr2
C.可用FeCl3溶液检测利尿酸中是否含有兴奋剂X
D.1mol兴奋剂X最多都能和5molNaOH的溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是一种重要的有机合成中间体,经常用来合成多种高分子化合物。已知A分子中不含甲基。由A合成的两种高分子化合物的路线如下图所示:
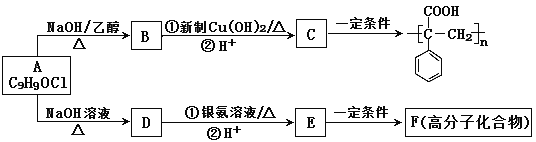
(1)写出C中含有的官能团名称___________________ 。
(2)由A生成B的反应类型为______________________________________。
(3)C的核磁共振氢谱有________组峰
(4)写出A生成D的化学方程式_______________________________________。
(5)F的结构简式是___________________。
(6)苯环上的二取代芳香化合物W是D的同分异构体,且W分子中只具有一个官能团,则W的结构共有_____________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二氧化硫与一氧化碳能迅速发生如下反应:SO2+2CO![]() S+2CO2。某同学利用如下图所示装置探究上述反应生成的气态产物,部分夹持仪器未画出。
S+2CO2。某同学利用如下图所示装置探究上述反应生成的气态产物,部分夹持仪器未画出。
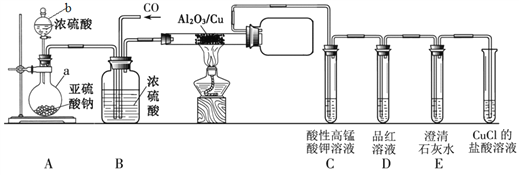
查阅资料知:CO不能被酸性高锰酸钾溶液氧化,CuCl的盐酸溶液能吸收CO。回答下列问题:
(1)仪器a的名称是_____________。装置A中发生的反应是否属于氧化还原反应:________(填“是” 、“否”)。
(2)装置B中浓硫酸表现出的性质是________________。
(3)亚硫酸钠暴露在空气中易变质,其反应的化学方程式为___________。
(4)装置C、D、E用来除去未反应的SO2并检验反应生成的CO2。
①装置D中品红溶液的作用是______________________________。
②配平装置C中反应的离子方程式:_____
SO2 + MnO4ˉ + H2O — SO42ˉ + Mn2+ + H+
③下列溶液中,不能替换酸性高锰酸钾溶液的是_________(填字母标号)。
A.溴水 B.饱和NaHCO3溶液 C.Na2SO3溶液
D. Fe2(SO4)3溶液 E.Na2CO3溶液
④有同学认为,省略去装置D,也能达到同样的实验目的。此时装置C中观察到的现象______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2之间存在反应:N2O4(g)![]() 2NO2 (g) ΔH=+57.2 kJ/mol。
2NO2 (g) ΔH=+57.2 kJ/mol。
(1)将一定量N2O4加入到恒温恒容的密闭容器中。
①能说明该反应达到平衡状态的是____
a.v正(N2O4)=2v逆(NO2)
b.容器中气体的温度不变
c.容器中气体平均相对分子质量不变
d.混合气体密度不变
②达到平衡状态后,保持体积不变升高温度,再次到达平衡状态时混合气体颜色_______(填“变深”、“变浅”或“不变”), 判断理由___________。
(2)将一定量N2O4加入到恒温恒压的密闭容器中(温度298K、压强100kPa)。该反应中,正反应速率v正=k正×p(N2O4),逆反应速率v逆=k逆×p2(NO2),其中k正、k逆为速率常数,p为分压(分压=总压×物质的量分数),则该反应的压强平衡常数Kp=_____(以k正、k逆表示)。若该条件下k正=4.4×104s-1,当N2O4分解10%时,v正=____kPa·s-1
(3)将一定量N2O4加入到恒容密闭容器中。测得不同温度下,N2O4的平衡转化率a如图所示。已知N2O4的起始压强p0为210kPa,计算图中a点对应温度下反应的压强平衡常数Kp=______。
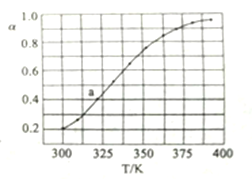
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com