
����Ŀ����14�֣�Li4Ti3O12��LiFePO4��������ӵ�صĵ缫���ϣ���������������Ҫ�ɷ�ΪFe TiO3 �� ����������MgO��SiO2�����ʣ����Ʊ��������������£�
�ش��������⣺
��1���������ʵ���У����Ľ����ʽ������ͼ��ʾ����ͼ��֪�������ľ�����Ϊ70%ʱ�������õ�ʵ������Ϊ �� 
��2���������������Ҫ��TiOCl42����ʽ���ڣ�д����Ӧ��Ӧ�����ӷ���ʽ ��
��3��TiO2xH2O������˫��ˮ����ˮ��Ӧ40min����ʵ�������±���ʾ:
�¶�/�� | 30 | 35 | 40 | 45 | 50 |
TiO2xH2Oת����/% | 92 | 95 | 97 | 93 | 88 |
����40��ʱTiO2xH2Oת������ߵ�ԭ�� ��
��4��Li2Ti5O15��Ti�Ļ��ϼ�Ϊ+4�����й���������ĿΪ ��
��5��������Һ�ڡ���c��Mg2+��=0.02molL��1 �� ����˫��ˮ�����ᣨ����Һ�������1������ʹFe3+ǡ�ó�����ȫ����Һ��c��Fe3+��=1.0��10��5 �� ��ʱ�Ƿ���Mg3��PO4��2�������ɣ�����ʽ���㣩��FePO4��Mg3��PO4��2�ķֱ�Ϊ1.3��10��22��1.0��10��24
��6��д�����������բڡ�����FePO4�Ʊ�LiFePO4�Ļ�ѧ����ʽ ��
���𰸡�
��1��100�棬2h��90�棬5h
��2��FeTiO3+4H++4Cl��=Fe2++TiOCl42��+2H2O
��3������40�棬TiO2��xH2Oת����Ӧ�������¶����߶����ӣ�����40�棬˫��ˮ�ֽ��백���ݳ�����TiO2��xH2Oת����Ӧ�����½�
��4��4
��5��c��PO43����= ![]() =1.0��10��17mol/L��Qc[Mg3��PO4��2]=��
=1.0��10��17mol/L��Qc[Mg3��PO4��2]=�� ![]() ��3����1.0��10��17mol/L��2=1.69��10��40��Ksp=1.0��10��24 �� ����������
��3����1.0��10��17mol/L��2=1.69��10��40��Ksp=1.0��10��24 �� ����������
��6��2FePO4+Li2CO3+H2C2O4 ![]() LiFePO4+H2O+3CO2��
LiFePO4+H2O+3CO2��
����������1����ͼ��֪�������ľ�����Ϊ70%ʱ��100��ʱ��ʱ�����٣������õ�ʵ������Ϊѡ���¶�Ϊ100�棬
�ʴ�Ϊ��ѡ���¶�Ϊ100�棻��2���������������Ҫ��TiOCl42����ʽ���ڣ���Ӧ��Ӧ�����ӷ���ʽΪFeTiO3+4H++4Cl��=Fe2++TiOCl42��+2H2O��
�ʴ�Ϊ��FeTiO3+4H++4Cl��=Fe2++TiOCl42��+2H2O����3��40��ʱTiO2xH2Oת������ߣ����¶ȸ߷�Ӧ���ʼӿ죬���¶ȹ��߹�������ֽ⡢��ˮ�ӷ���Ӱ��ת���ʣ��ʴ�Ϊ���¶ȸ߷�Ӧ���ʼӿ죬���¶ȹ��߹�������ֽ⡢��ˮ�ӷ���Ӱ��ת���ʣ���4��Li2Ti5O15��Ti�Ļ��ϼ�Ϊ+4��Li�Ļ��ϼ�Ϊ+1�ۣ��ɻ��ϼ۵Ĵ�����Ϊ0��֪��OԪ�صĸ��۴�����Ϊ22�������������ĿΪx����x��2����1+��15��x��2����2=22�����x=4���ʴ�Ϊ��4����5��Fe3+ǡ�ó�����ȫ����Һ��c��Fe3+��=1.0��10��5 �� ��Ksp��FePO4������֪c��PO43����= ![]() =1.0��10��17mol/L��Qc[Mg3��PO4��2]=��
=1.0��10��17mol/L��Qc[Mg3��PO4��2]=�� ![]() ��3����1.0��10��17mol/L��2=1.69��10��40��Ksp=1.0��10��24 �� ���������ɣ�
��3����1.0��10��17mol/L��2=1.69��10��40��Ksp=1.0��10��24 �� ���������ɣ�
�ʴ�Ϊ��c��PO43����= ![]() =1.0��10��17mol/L��Qc[Mg3��PO4��2]=��
=1.0��10��17mol/L��Qc[Mg3��PO4��2]=�� ![]() ��3����1.0��10��17mol/L��2=1.69��10��40��Ksp=1.0��10��24 �� ���������ɣ���6�����������բڡ�����FePO4�Ʊ�LiFePO4�Ļ�ѧ����ʽΪ2FePO4+Li2CO3+H2C2O4
��3����1.0��10��17mol/L��2=1.69��10��40��Ksp=1.0��10��24 �� ���������ɣ���6�����������բڡ�����FePO4�Ʊ�LiFePO4�Ļ�ѧ����ʽΪ2FePO4+Li2CO3+H2C2O4 ![]() LiFePO4+H2O+3CO2����
LiFePO4+H2O+3CO2����
�ʴ�Ϊ��2FePO4+Li2CO3+H2C2O4 ![]() LiFePO4+H2O+3CO2����
LiFePO4+H2O+3CO2����
����������Ҫ�ɷ�ΪFe TiO3 �� ����������MgO��SiO2�����ʣ����Ʊ�Li4Ti3O12��LiFePO4 �� ���Ʊ����̿�֪����������˺������ΪSiO2 �� ��Һ���к�Mg2+��Fe2+��Ti4+ �� ˮ�����ˣ�����ΪTiO2 �� xH2O����˫��ˮ��ӦTiԪ�صĻ��ϼ����ߣ����ɣ�NH4��2Ti5O15 �� ��LiOH��Ӧ����˵õ�Li2Ti5O15 �� ����̼��﮸��·�Ӧ����Li4Ti3O12��ˮ������Һ���к�Mg2+��Fe2+ �� ˫��ˮ�������������ӣ������������¹��˷����FePO4 �� �������բ��з���2FePO4+Li2CO3+H2C2O4 ![]() LiFePO4+H2O+3CO2
LiFePO4+H2O+3CO2



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�仯�У����ܷ����ı����(����)
A.������B.������C.���������D.ԭ�Ӻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɱ��۵�ܵ������ڣ� ��
A.CO2�ǷǼ��Է���
B.C=O���ļ��ܺ�С
C.CO2��ѧ���ʲ�����
D.CO2���Ӽ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ�ķе�Ϊ100�棬����ķ��ӽṹ��ˮ���ƣ������ķе�ȴ�ܵͣ��ǩ�60.7�棬�������ֲ������Ҫԭ���ǣ� ��
A.���»���
B.���ۼ�
C.���
D.��Է�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����¶Ȳ���������£��ں��ݵ������н������з�Ӧ��N2O4(g)=2NO2(g)����N2O4��Ũ����0.1mol/L����0.07mol/L��Ҫ15s����ôN2O4��Ũ����0.07mol/L����0.05mol/L����ķ�Ӧʱ��(���� )
A. ����5s B. ����10s C. ��10s D. ����10s
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��װ��ͼ�������ǣ� ��
A.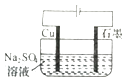 װ�ÿ�ʵ�֣�Cu+2H2O
װ�ÿ�ʵ�֣�Cu+2H2O ![]() Cu��OH��2+H2��
Cu��OH��2+H2��
B.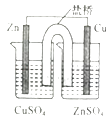 װ���ܹ���пͭԭ���
װ���ܹ���пͭԭ���
C.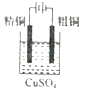 װ�ÿ����ڴ�ͭ�ĵ�⾫��
װ�ÿ����ڴ�ͭ�ĵ�⾫��
D.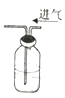 װ�ÿ�����Ũ�����������
װ�ÿ�����Ũ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y�к�����ͬ��Ԫ�أ�Z��W��Ҳ������ͬ��Ԫ�أ����ݷ�ӦX+H2O ��Y+H2 �� ��Z+H2O ��W+O2 ��������ʽ��δ��ƽ�������ƶ�X��Y�м�Z��W����ͬԪ�صĻ��ϼ۵ĸߵ�˳��Ϊ
A. X��Y��Z��W B. X��Y��Z��W C. X��Y�� Z��W D. X��Y��Z��W
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯�У���Ҫ���뻹ԭ�����ǣ� ��
A. Cl-��Cl2 B. FeCl3��FeCl2
C. C��CO2 D. KMnO4��K2MnO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����廯�ơ��⻯�ƵĻ����Һ��ͨ���������������Ƚ���Һ���ɣ����������������ٸı�Ϊֹ����� ������������
A.NaClB.NaCl��NaBr��NaIC.NaBr��NaID.NaI
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com