
过氧化物是一类非常重要的化合物,从人们制得第一种过氧化物距今已有200多年的历史了,在众多的过氧化物中过氧化氢迄今为止仍然得到广泛的应用。
(1)与H2O2具有相同的电子总数的双原子分子有 (写两种);
(2)若从海水中提取碘,需将碘化物变成单质碘。写出在酸性条件下H2O2氧化I—离子的离子方程式 ;
(3)Na2O2、K2O2、CaO2和BaO2都能与酸作用生成H2O2,目前实验室制取H2O2可通过上述某种过氧化物与适量的稀H2SO4作用并过滤后获得,其中最适合的过氧化物是 (填化学式);
(4)纯H2O2可用作火箭燃料的氧化剂,已知0.4mol液态肼(N2H4)与足量的液态H2O2反应,生成N2(g)和H2O(g),放出256.6kJ的热量,则该反应的热化学方程式是 。
(1)HCl、F2(共2分,各1分)
(2)H2O2+2I—+2H+= I2+2H2O(3分,没配平扣1分,其他错误0分)
(3)BaO2(2分)
(4)N2H4(l)+2H2O2(l) = N2(g)+4H2O(g) △H=—641.5kJ·mol—1(3分。没配平,没标状态,△H没标单位均扣1分,其他错误0分)
解析试题分析:⑴H2O2是18个电子的分子,具有18个电子的双原子分子是:HCl、F2,答案:HCl、F2;⑵H2O2是氧化剂,将I―氧化成I2, 酸性条件下H2O2氧化I—离子的离子方程式:H2O2+2I—+2H+= I2+2H2O,答案:H2O2+2I—+2H+= I2+2H2O;⑶Na2O2、K2O2、CaO2和BaO2与H2SO4反应后除H2O2外,另一种物质分别是:Na2SO4、K2SO4、CaSO4、BaSO4,其中BaSO4在水中溶解度最小,便于与H2O2分离,最适合的过氧化物是:BaO2,答案:BaO2;⑷先写出方程式,N2H4(l)+2H2O2(l) = N2(g)+4H2O(g) ,根据方程式算出1molN2H4燃烧放出的热量是: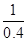 ×256.6kJ=641.5kJ,反应的热化学方程式是:N2H4(l)+2H2O2(l) = N2(g)+4H2O(g) △H=—641.5kJ·mol—1,答案:N2H4(l)+2H2O2(l) = N2(g)+4H2O(g) △H=—641.5kJ·mol—1。
×256.6kJ=641.5kJ,反应的热化学方程式是:N2H4(l)+2H2O2(l) = N2(g)+4H2O(g) △H=—641.5kJ·mol—1,答案:N2H4(l)+2H2O2(l) = N2(g)+4H2O(g) △H=—641.5kJ·mol—1。
考点:元素及其化合物,热化学方程式的书写


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
某化学兴趣小组用含铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下图所示: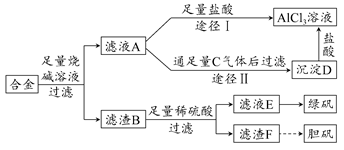
试回答下列问题:
(1)过滤时用的器材已有:滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是________。
(2)由滤液A制AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是________,理由是_____________________________。
(3)从滤液E中得到绿矾晶体的实验操作是________。
(4)写出用滤渣F制备胆矾晶体的化学方程式_______________________。
(5)有同学提出可将方案中最初用于溶解合金的烧碱改为盐酸,重新设计方案,也能制得这三种物质,你认为后者的方案是否合理?________,理由是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,某研究性学习小组欲分析其成分,实验记录如下图所示。
(1)该矿石中含有 (填化学式),请写出实验过程①中反应的离子方程式 。
(2)将氧化物Ⅱ在熔融状态下电解,可以得到某金属单质。当阳极上收集到气体33.6L(已折算成标准状况)时,阴极上得到该金属 g。
(3)试写出该金属与氧化物I反应的化学方程式 ;将该反应的产物加入到足量烧碱溶液中,请写出发生反应的离子方程式 。
(4)经进一步分析该矿石中还含有微量的SrCO3(上述方案检测不出)。锶(Sr)为第五周期ⅡA族元素。下列叙述正确的是 (填序号)。
①氯化锶(SrCl2)溶液显酸性
②SrSO4难溶于水
③工业上可以用电解SrCl2的水溶液制取金属锶(Sr)
④高纯六水氯化锶晶体(SrCl2·6H2O)必须在HCl氛围中加热才能得到SrCl2
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W是元素周期表前四周期的常见元素,其相关信息如下表:
| X | X的一种核素的质子数为56,中子数为30 |
| Y | 海水中元素含量最高的金属元素 |
| Z | 常温常压下,Z单质是淡黄色固体,常在火山口附近沉积 |
| W | 价电子的排布式为3s23p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D是原子序数依次增大的短周期主族元素,A、C在元素周期表中的相对位置如图,A元素最外层与次外层上的电子数之差为3,B为地壳中含最最多的金属元素。
| A | |
| | C |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物。
(1)A能溶于强酸、强碱,写出A与强碱溶液反应的离子方程式_______________。
(2)B、D都是酸性氧化物且组成元素相同,D溶于水得强酸,则B、D分子中除氧元素外所含另一种元素在周期表中的位置是_______________。
(3)E能使湿润的红色石蕊试纸变蓝,实验室制取E气体的化学方程式为________________,制得的气体可用如图所示装置收集,则气体应从_______(填“A”或“B”)通入。
(4)由各分解产物的物质的量之比推测X的组成类似于明矾,则其化学式为___________,若向X的浓溶液中滴加浓NaOH溶液至过量,现象依次为_______________ 、___________ _、
_____________ 。
(5)取一定量的X晶体分解,若生成F 1 mol,则必同时生成_______ 物质_____ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大。有关信息如下表:
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
几种短周期元素的原子半径和主要化合价见下表,下列说法中正确的是( )。
| 元素代号 | 原子半径/nm | 主要化合价 |
| X | 0.160 | +2 |
| Y | 0.143 | +3 |
| Z | 0.102 | +6、-2 |
| L | 0.099 | +7、-1 |
| M | 0.077 | +4、-4 |
| Q | 0.074 | -2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com