
几种短周期元素的原子半径和主要化合价见下表,下列说法中正确的是( )。
| 元素代号 | 原子半径/nm | 主要化合价 |
| X | 0.160 | +2 |
| Y | 0.143 | +3 |
| Z | 0.102 | +6、-2 |
| L | 0.099 | +7、-1 |
| M | 0.077 | +4、-4 |
| Q | 0.074 | -2 |
D
解析试题分析:短周期元素,由元素的化合价可知,Q只有-2价,则Q为O元素,Z有+6、-2价,可知Z为S元素;L有+7、-1价,则L为氯元素;M有+4、-4价,原子半径L>M,则M为C元素;X为+2价,Y为+3价,原子半径X>Y>Z,所以X为Mg元素,Y为Al元素,则A、X为Mg元素,Y为Al元素,等物质的量的X、Y的单质与足量盐酸反应,根据电子转移守恒可知,二者生成H2为2:3,故A错误;B、Y与Q形成的化合物为Al2O3,氧化铝是两性氧化物,与氢氧化钠溶液反应生成偏铝酸钠,故B错误;C、非金属性Cl>S,所以稳定性HCl>H2S,即L的氢化物的稳定性强于Z的氢化物的稳定性,故C错误;D、M为C元素,最外层电子数为4,电子不易得失,与其它原子易形成共价键而不易形成离子键,故D正确,故选:D。
考点:考查元素的性质与位置关系


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:填空题
下列叙述正确的是______________。
①SO2、NO、NO2都是形成酸雨的因素,都能和水反应生成酸
②除去CO2中少量的SO2,将混合气体通过饱和Na2CO3溶液
③水晶的主要成分是SiO2
④SiO2与CO2都属于酸性氧化物,都不能与酸反应
⑤将CO2通入饱和Na2CO3溶液中有沉淀产生,继续通入CO2沉淀溶解
⑥某酸雨样本采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2
⑦CO2不能与CaCl2溶液反应,SO2也不能与CaCl2溶液反应
⑧实验室可用NaOH溶液处理NO2和SO2废气
⑨用稀双氧水清洗伤口可以杀菌消毒
⑩NO只能用排水集气法收集,不能用排空气法收集;而NO2只能用排空气法收集,不能用排水集气法
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
过氧化物是一类非常重要的化合物,从人们制得第一种过氧化物距今已有200多年的历史了,在众多的过氧化物中过氧化氢迄今为止仍然得到广泛的应用。
(1)与H2O2具有相同的电子总数的双原子分子有 (写两种);
(2)若从海水中提取碘,需将碘化物变成单质碘。写出在酸性条件下H2O2氧化I—离子的离子方程式 ;
(3)Na2O2、K2O2、CaO2和BaO2都能与酸作用生成H2O2,目前实验室制取H2O2可通过上述某种过氧化物与适量的稀H2SO4作用并过滤后获得,其中最适合的过氧化物是 (填化学式);
(4)纯H2O2可用作火箭燃料的氧化剂,已知0.4mol液态肼(N2H4)与足量的液态H2O2反应,生成N2(g)和H2O(g),放出256.6kJ的热量,则该反应的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
食用加碘盐的生产流程如下: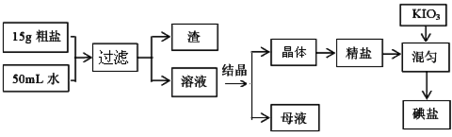
(1)检验母液中是否含有SO42-离子的方法是 。
(2)过滤时,用到的玻璃仪器有: 、 、 。
(3)国家标准GB546061-92规定碘盐含碘量(以碘计):出厂产品≥40mg/Kg;销售品≥30mg/Kg。某次实验时向一干净的坩埚中放入5g精盐,加入1mL0.001mol/L标准KIO3溶液搅拌均匀,在100℃恒温烘干1 h,即得碘盐产品,该碘盐的含碘量约为______mg/Kg(保留一位小数),是否为合格产品 (选填“合格”或“不合格”)。
(4)检验碘盐是否加有碘酸钾,定性检验方法是在酸性介质中加还原剂KCNS,其反应如下:6IO3-+5CNS-+H++2H2O→3I2+5HCN+5SO42-,检验时,除需用KCNS外,还需要使用的一种试剂是 。
(5)使用碘盐时,要防止高温,是因为:① 碘盐中的碘酸钾在560℃开始分解产生无色气体,剩余固体中加硝酸酸化的硝酸银溶液有黄色沉淀生成;② 碘盐在热水中,也会反应生成两种单质,其中一种是无色气体,在反应后的溶液中滴加酚酞试液显红色。根据以上信息写出①、②中发生反应的化学方程式:
① ;
② 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列大小比较正确的是
| A.离子半径:Na+>Mg2+>Al3+>Cl—;原子半径:Na>Mg>Al>Cl |
| B.稳定性:HF>H2O>NH3>CH4; 还原性: HF < H2O < NH3< CH4 |
| C.碱性:CsOH>KOH>Mg(OH)2>NaOH ; 金属性:Cs>K>Mg>Na |
| D.酸性:HClO>H2SO4>H2CO3;非金属性Cl>S>C |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
美国科学家将两种元素铅和氪的原子核对撞,获得了一种质量数为293、中子数为175的超重元素,该元素原子的质子数为
| A.118 | B.175 | C. 47 | D.293 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“ · ”代表一种元素,其中O点代表氢元素.下列说法中错误的是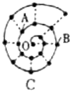
A.离O点越远的元素原子半径越大
B.虚线相连的元素处于同一族,A元素位于元素周期表ⅥA族
C.B元素是图中金属性最强的元素
D.B、C最高价氧化物的水化物可以相互反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com