
【题目】草酸钴可用于指示剂和催化剂的制备。用含钴废料(主要成分为Co,含有一定量的NiO、Al2O3、Fe、SiO2等)制备草酸钴晶体(CoC2O4·2H2O)的流程如下:
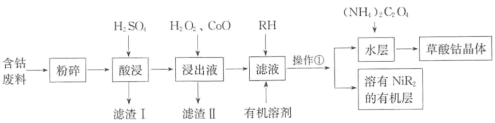
已知:①草酸钴晶体难溶于水:②RH为有机物(难电离)。
回答下列问题:
(1)酸浸时钴溶解反应的化学方程式为_______,浸出液中加入H2O2后发生反应的离子方程式为______。
(2)加入氧化钴的目的是_______,滤渣的II主要成分是_______。
(3)操作①为____________(填操作名称)。
(4)已知:NH3·H2O![]() NH4++OH- Kb=1.8×10-5;
NH4++OH- Kb=1.8×10-5;
H2C2O4![]() H ++HC2O 4- Ka1=5.4×10-2
H ++HC2O 4- Ka1=5.4×10-2
HC2O4-![]() H ++C2O42- Ka2=5.4×10-5
H ++C2O42- Ka2=5.4×10-5
该流程中所用(NH4)2C2O4溶液的pH_________(填“>”“<"或"一")7.
(5)钴的含氧酸盐受热分解最终产物多为氧化物,已知18.3g CoC2O4·2H2O热分解质量变化过程如图所示(其中600 °C以前是隔绝空气加热,6000 °C以后是在空气中加热),A、B、C均为纯净物。
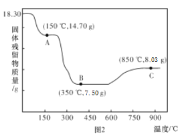
①A点对应物质的化学式为________________
②B →C反应的化学方程式为____________________。
【答案】Co + H2SO4 = CoSO4 +H2↑ 2Fe2+ + 2H+ + H2O2 = 2Fe3+ + 2H2O 调节溶液的pH,沉淀Fe3+和Al3+ Fe(OH)3、Al(OH)3 萃取分液 < CoC2O4 6CoO + O2 ![]() 2Co3O4
2Co3O4
【解析】
含钴废料(主要成分为Co,含有一定量的NiO、Al2O3、Fe、SiO2等)与硫酸反应生成硫酸钴、硫酸亚铁、硫酸铝和硫酸镍,二氧化硅不反应,过滤,滤渣为二氧化硅,滤液先加入双氧水氧化亚铁离子变为铁离子,加入氧化钴调节溶液的pH值,沉淀铁离子和铝离子,过滤,向滤液中加入RH和有机溶剂,萃取分液除掉Ni2+,向水层中加入草酸铵得到草酸钴晶体。
⑴酸浸时钴溶解是钴和硫酸反应生成硫酸钴和氢气,反应的化学方程式为Co + H2SO4 = CoSO4 +H2↑,浸出液中加入H2O2主要是亚铁离子被H2O2氧化变为铁离子,反应的离子方程式为2Fe2+ + 2H+ + H2O2 = 2Fe3+ + 2H2O;故答案为:Co + H2SO4 = CoSO4 +H2↑;2Fe2+ + 2H+ + H2O2 = 2Fe3+ + 2H2O。
⑵加入氧化钴,发生CoO + 2H+ = Co2+ + H2O,调节溶液的pH,使Fe3+和Al3+转化为沉淀,根据前后联系得出滤渣的II主要成分是Fe(OH)3、Al(OH)3;故答案为:调节溶液的pH,沉淀Fe3+和Al3+;Fe(OH)3、Al(OH)3。
⑶根据有机层与水层得出操作①为萃取分液;故答案为:萃取分液。
⑷该流程中所用(NH4)2C2O4溶液,铵根水解显酸性,草酸根水解显碱性,谁的水解程度越大显谁的性质,NH4+的![]() ,C2O42的
,C2O42的![]() ,则NH4+的水解程度大于C2O42的水解程度,溶液显酸性,因此pH<7;故答案为:<。
,则NH4+的水解程度大于C2O42的水解程度,溶液显酸性,因此pH<7;故答案为:<。
⑸18.3g CoC2O4·2H2O物质的量为0.1mol,加热时先失去结晶水,若全部转化为CoC2O4,则固体质量为14.7g,故A为CoC2O4,继续加热,如果完全反应,可得到0.1molCoO(质量为7.5g),故B点为CoO,600 °C以后是在空气中加热,由固体质量增加可知,有空气中的成分进入固体,则CoO与空气中氧气反应,8.03g固体中Co的物质的量为0.1mol,质量为5.9g,所以氧的质量为2.13g,则氧的物质的量为0.133mol,由两者的物质的量之比可得C为Co3O4,B到C的反应方程式为6CoO + O2 ![]() 2Co3O4;故答案为:CoC2O4;6CoO + O2
2Co3O4;故答案为:CoC2O4;6CoO + O2 ![]() 2Co3O4。
2Co3O4。


科目:高中化学 来源: 题型:
【题目】下列有关实验室制取气体的反应中,其反应不属于氧化还原反应的是( )
A.实验室中用稀硫酸与Mg反应制取H2B.实验室中用高锰酸钾加热分解制取O2
C.实验室中用H2O2与MnO2作用产生O2D.实验室中用稀盐酸与石灰石反应制取CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,将 0.10 mol·L-1 CH3COOH 溶液滴加到 10 mL 0.10 mol·L-1 NaOH 溶液中,lg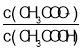 与pH 的关系如图所示,C 点坐标是(6,1.7)。下列说法不正确的是
与pH 的关系如图所示,C 点坐标是(6,1.7)。下列说法不正确的是
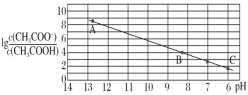
A.pH=7 时加入的醋酸溶液的体积大于 10 mL
B.C 点后继续加入醋酸溶液,水的电离程度减小
C.B 点存在 c(Na+)-c(CH3COO-)=(10-6-10-8)mol·L-1
D.Ka(CH3COOH)=10-4.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓差电池有多种:一种是利用物质氧化性或还原性强弱与浓度的关系设计的原电池(如图1):一种是根据电池中存在浓度差会产生电动势而设计的原电池(如图2)。图1所示原电池能在一段时间内形成稳定电流;图2所示原电池既能从浓缩海水中提取LiCl,又能获得电能。下列说法错误的是
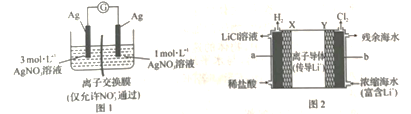
A.图1电流计指针不再偏转时,左右两侧溶液浓度恰好相等
B.图1电流计指针不再偏转时向左侧加入NaCl或AgNO3或Fe粉,指针又会偏转且方向相同
C.图2中Y极每生成1 mol Cl2,a极区得到2 mol LiCl
D.两个原电池外电路中电子流动方向均为从右到左
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜是一种常见的化工产品,它在纺织、印染、医药、化工、电镀以及木材和纸张的防腐等方面有极其广泛的用途。实验室制备硫酸铜的步骤如下:
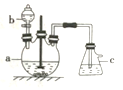
①在仪器a中先加入20g铜片、60 mL水,再缓缓加入17 mL浓硫酸:在仪器b中加入39 mL浓硝酸;在仪器c中加入20%的石灰乳150 mL。
②从仪器b中放出约5mL浓硝酸,开动搅拌器然后采用滴加的方式逐渐将浓硝酸加到仪器a中,搅拌器间歇开动。当最后滴浓硝酸加完以后,完全开动搅拌器,等反应基本停止下来时,开始用电炉加热直至仪器a中的红棕色气体完全消失,立即将导气管从仪器c中取出,再停止加热。
③将仪器a中的液体倒出,取出未反应完的铜片溶液冷却至室温.析出蓝色晶体.回答下列问题:
(1)将仪器b中液体滴入仪器a中的具体操作是__________。
(2)写出装置a中生成CuSO4的化学方程式:_______。
(3)步骤②电炉加热直至仪器a中的红棕色气体完全消失,此时会产生的气体是______,该气体无法直接被石灰乳吸收,为防止空气污染,请画出该气体的吸收装置(标明所用试剂及气流方向)______。
(4)通过本实验制取的硫酸铜晶体中常含有少量Cu(NO3)2,可来用重结晶法进行提纯,检验Cu(NO3)2是否被除净的方法是_______。
(5)工业上也常采用将铜在450 °C左右焙烧,再与一定浓度的硫酸反应制取硫酸铜的方法,对比分析本实验采用的硝酸氧化法制取CuSO4的优点是_______。
(6)用滴定法测定蓝色晶体中Cu2+的含量。取a g试样配成100 mL溶液,每次取20.00 mL用c mol·L-1EDTA(H2Y )标准溶液滴定至终点,平行滴定3次,平均消耗EDTA溶液b mL,滴定反应为Cu2++H2Y =CuY +2H+,蓝色晶体中Cu2+质量分数![]() _____%.
_____%.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.l mol·L-1的CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是
A. 加入少量CH3COONH4固体,平衡不移动,c(H+)不变
B. 加入少量NaOH固体,平衡向正向移动,溶液中c(H+)减小
C. 加水,平衡向正向移动,c(CH3COOH)/ c(CH3COO-)增大
D. 通入少量 HCl气体,平衡逆向移动,溶液中c(H+)减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Cl2与H2O的反应:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 铜丝插入Fe2(SO4)3溶液中:Cu +Fe3+ =Cu2+ +Fe2+
C. 向FeBr2溶液中通入过量Cl2:2Br-+Cl2=Br2+2Cl-
D. 向Na2SiO3溶液中通入过量CO2:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A~F的转化关系如下图所示。已知A在标准状况下的密度为1.25gL—1,D能发生银镜反应,F是难溶于水且有芳香气味的油状液体。
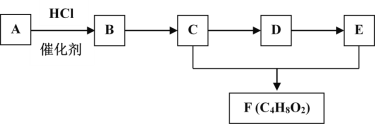
请回答:
(1)A中官能团名称为________。
(2)C→D的反应类型是_________。
(3)A和E一定条件下也可生成F的化学方程式是_______。
(4)下列说法正确的是______。
A.A和B都能使酸性KMnO4褪色
B.D和E能用新制氢氧化铜悬浊液检验
C.可以用饱和碳酸钠溶液除去C、E和F混合物中的C、E
D.推测有机物F可能易溶于乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧后的烧渣(主要成分为Fe2O3、 SiO2、A12O3,不考虑其他杂质)制取绿碱FeSO47H2O),设计了如下流程(部分物质已略去)。
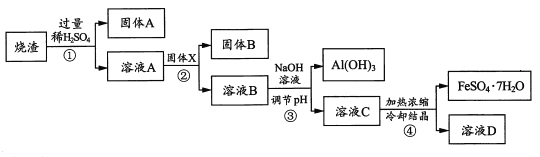
请回答:
(1)①一④所涉及的实验操作方法中,包含过滤的有____(写序号)。
(2)写出①中反应的离子方程式:____。
(3)下列说法正确的是___(填字母)。
a.固体x为铁粉
b.溶液B中含有的阳离子主要是Fe2+、Fe3+、Al3+
c.从溶液C到绿矾的过程中,须控制条件防止其氧化
(4)为测定烧渣中Fe2O3的含量,甲同学通过实验测得如下数据:烧渣的质量为ag,固体x的质量为bg,固体B的质量为cg。乙同学认为仅利用以上数据不能计算出烧渣中Fe2O3的含量,其理由是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com