
【题目】在0.l mol·L-1的CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是
A. 加入少量CH3COONH4固体,平衡不移动,c(H+)不变
B. 加入少量NaOH固体,平衡向正向移动,溶液中c(H+)减小
C. 加水,平衡向正向移动,c(CH3COOH)/ c(CH3COO-)增大
D. 通入少量 HCl气体,平衡逆向移动,溶液中c(H+)减少
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】2019年12月以来,我国部分地区突发的新冠肺炎疫情严重威胁着人们的身体健康。研究发现洛匹那韦对新冠病毒有较好抑制作用,洛匹那韦能溶于水,其结构如图所示,下列说法不正确的是
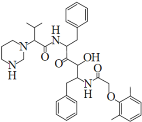
A.洛匹那韦的分子式为C37H48N4O5
B.洛匹那韦能发生取代、加成、消去、氧化、还原反应
C.洛匹那韦的水解产物之一遇Fe3+可显紫色
D.洛匹那韦能溶于水与氢键作用有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷、乙烯、乙醇都是重要的有机化合物。请回答下列问题:
(1)甲烷与氯气的第一步取代反应的化学方程式为____。
(2)把乙烯通入到溴的四氯化碳溶液中,充分振荡、静置,观察到溴的四氯化碳溶液褪色,写出该过程中发生反应的化学方程式___。
(3)下列几组物质中,互为同分异构体的是___,互为同位素的是___,互为同素异形体的是______,属于同一种物质的是__。
A.甲烷与新戊烷 B.氧气和臭氧 C.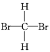 和
和![]() D.35Cl和37Cl E.CH3CH2OH和CH3OCH3
D.35Cl和37Cl E.CH3CH2OH和CH3OCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ加入CO0.8mol、Cl20.8mol,达到平衡时CO转化率大于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴可用于指示剂和催化剂的制备。用含钴废料(主要成分为Co,含有一定量的NiO、Al2O3、Fe、SiO2等)制备草酸钴晶体(CoC2O4·2H2O)的流程如下:
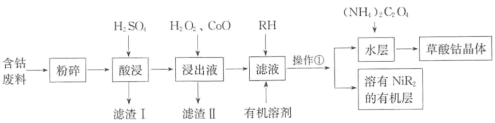
已知:①草酸钴晶体难溶于水:②RH为有机物(难电离)。
回答下列问题:
(1)酸浸时钴溶解反应的化学方程式为_______,浸出液中加入H2O2后发生反应的离子方程式为______。
(2)加入氧化钴的目的是_______,滤渣的II主要成分是_______。
(3)操作①为____________(填操作名称)。
(4)已知:NH3·H2O![]() NH4++OH- Kb=1.8×10-5;
NH4++OH- Kb=1.8×10-5;
H2C2O4![]() H ++HC2O 4- Ka1=5.4×10-2
H ++HC2O 4- Ka1=5.4×10-2
HC2O4-![]() H ++C2O42- Ka2=5.4×10-5
H ++C2O42- Ka2=5.4×10-5
该流程中所用(NH4)2C2O4溶液的pH_________(填“>”“<"或"一")7.
(5)钴的含氧酸盐受热分解最终产物多为氧化物,已知18.3g CoC2O4·2H2O热分解质量变化过程如图所示(其中600 °C以前是隔绝空气加热,6000 °C以后是在空气中加热),A、B、C均为纯净物。
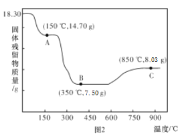
①A点对应物质的化学式为________________
②B →C反应的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛(CH3CHO)是有机合成中的二碳试剂,是合成乙酸、乙醇、乙酸乙酯、农药DDT等的原料。回答下列问题:
(1)Andrea Dasic 等提出在金属催化剂M作用下以N2O为氧化剂可以氧化乙烯生成乙醛。催化体系氧化还原循环如图所示。(物质与氧原子的结合力用OA表示)

氧原子与N生成NO的结合力OA(N)= 167.4kJ·mol-1,氧原子与乙烯生成乙醛的结合力OA(C2 H4)=473 kJmol-1,则可用作该反应催化剂的金属M与氧原子的结合力OA(M)的值应满足:_______,使用催化剂会使该反应的活化能____(填“增大”或“减小”)。
(2)已知CO(g)、CH4(g)、CH3CHO(l)的燃烧热分别为283.0 kJmol-1、890.31 kJ· mol-1、1167.9 kJmol-1,则乙醛的分解反应CH3CHO(l) ![]() CH4(g)+CO(g)的 H =________。
CH4(g)+CO(g)的 H =________。
(3)已知:在含有少量I2的溶液中,反应CH3CHO(aq) ![]() CH4 (g)+CO(g)分两步进行:
CH4 (g)+CO(g)分两步进行:
第I步反应为CH3CHO(aq) +I2(aq)→CH3I(l) + HI(aq) +CO(g)(慢反应),第II步为快反应。
①请写出第II步反应的化学方程式:__________。
②增大I2的浓度______(填“能"或“不能")明显增大总反应的平均速率,理由为_________。
(4)乙醛可以与饱和的NaHSO3溶液发生反应生成水溶性的![]() -羟基磺酸钠:CH3CHO+ NaHSO3
-羟基磺酸钠:CH3CHO+ NaHSO3![]() CH3CH(OH)SO3Na(
CH3CH(OH)SO3Na(![]() -羟基磺酸为易溶于水的强酸)。反应达到平衡后,若其他条件不变,向反应体系中加入足量盐酸,平衡将___ (填“ 正向”“逆向”或“不")移动。
-羟基磺酸为易溶于水的强酸)。反应达到平衡后,若其他条件不变,向反应体系中加入足量盐酸,平衡将___ (填“ 正向”“逆向”或“不")移动。
(5)在100~120 °C、PdCl2 – CuCl2催化剂存在下,乙烯可以与O2反应生成乙醛: 2CH2=CH2(g) +O2(g) ![]() 2CH3CHO(g)。 T°C时,向2 L的恒容密闭容器中通入3 mol CH2=CH2(g)和3 mol O2(g),发生上述反应,反应刚好达到平衡状态后体系压强变为初始压强的5/6,则CH2=CH2(g)的平衡转化率为____ (结果保留3位有效数字),T °C时该反应的平衡常数K为________。
2CH3CHO(g)。 T°C时,向2 L的恒容密闭容器中通入3 mol CH2=CH2(g)和3 mol O2(g),发生上述反应,反应刚好达到平衡状态后体系压强变为初始压强的5/6,则CH2=CH2(g)的平衡转化率为____ (结果保留3位有效数字),T °C时该反应的平衡常数K为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示。下列说法正确的是
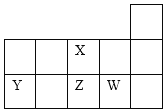
A.Y、Z、X三种元素的原子半径依次增大
B.X、Z都是第二周期ⅥA族元素,单质的氧化性X>Z
C.Y的气态氢化物的热稳定性比Z的高
D.W元素最高价氧化物的水化物的酸性比Z的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:链烃A(C5H8)有支链且只有一个官能团。有机化合物A→H、A→F的转换关系如下所示:
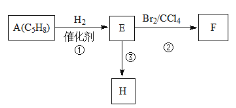
(1)A的结构简式是____________,名称是_______________。
(2)链烃B是A的不同类别的同分异构体,B经催化氢化转化为正戊烷,写出B的结构简式_____________________。(写一个)
(3)已知,H是高分子化合物,写出E→H反应的方程式________________________________________。
(4)写出反应类型:反应②_________________________,反应③_________________________。
(5)设计一条由电石制取聚氯乙烯的合成路线(其他试剂自选)。_____________________________(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气系统中的催化转化器,可有效降低尾气中的CO、NO和NO2等向大气的排放。在催化转化器的前半部发生的反应为2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)。一定条件下,下列说法能充分说明该反应已经达到化学平衡状态的是
2CO2(g)+N2(g)。一定条件下,下列说法能充分说明该反应已经达到化学平衡状态的是
A. 正、逆反应速率都等于零B. CO、NO、CO2、N2的浓度相等
C. CO、NO、CO2、N2在容器中共存D. CO、NO、CO2、N2的浓度均不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com