
| A、0.01mol/L的CH3COOH |
| B、0.01mol/LHCl0 |
| C、0.01mol/LHF |
| D、0.005mol/LH2SO4 |


科目:高中化学 来源: 题型:
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
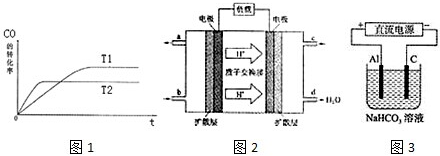
查看答案和解析>>
科目:高中化学 来源: 题型:
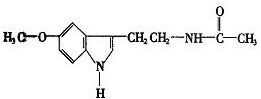 脑白金的主要作用是改善睡眠和润肠通便,主要成分是褪黑素(Melatonin)和低聚糖,其有效成分的结构简式如图,下列对该化合物的叙述正确的是( )
脑白金的主要作用是改善睡眠和润肠通便,主要成分是褪黑素(Melatonin)和低聚糖,其有效成分的结构简式如图,下列对该化合物的叙述正确的是( )| A、②③ | B、③ | C、③④ | D、①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:60 | B、3:1 |
| C、100:1 | D、1:100 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入适量的稀硫酸 |
| B、加入适量的盐酸 |
| C、加入适量的氢氧化钙溶液 |
| D、加入适量的氯化钙溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氟气通入水中:2F2+2H2O═4F-+4H++O2 |
| B、向小苏打溶液中加入过量的石灰水:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |
| C、硫氢化钠溶液与盐酸反应:S2-+2H+═H2S↑? |
| D、FeBr2溶液与等摩Cl2反应:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com