
| 2-0.2��2 |
| 2 |
| 2-0.2��2 |
| 2 |
| ��-��+�ۡ�4 |
| 2 |
| (-a)-(-b)+(-c)��4 |
| 2 |
| b-a-4c |
| 2 |
| b-a-4c |
| 2 |
| 6.4 |
| 32 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�� ����K2CO3�е�K+ |
B�� ������ˮ |
C�� ϡ��Ũ���� |
D�� ��ȥCO��CO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� |
| t/min | 0 | 5 | 10 |
| AO/mol?L��1 | 1.00 | 0.65 | 0.50 |
| H2/mol?L��1 | 2.00 | 1.00 | |
| AH3OH/mol?L��1 | 0.00 | 0.35 | 0.50 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��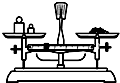 |
B��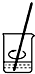 |
C��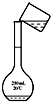 |
D�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������KOH���� |
| B�������Ȼ��ع��� |
| C������CaCO3 |
| D������Na2SO3���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
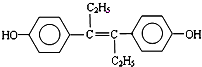
| A��M���ڷ����廯���� |
| B��M����NaOH��Һ��NaHCO3��Һ������Ӧ |
| C��1molM�������7molH2�����ӳɷ�Ӧ |
| D��1molM�뱥����ˮ��ϣ��������5molBr2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.01mol/L��CH3COOH |
| B��0.01mol/LHCl0 |
| C��0.01mol/LHF |
| D��0.005mol/LH2SO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������ƽ��ṹ |
| B����������ˮ������Ӧ |
| C����һ�������¶�����H2�����ӳɷ�Ӧ |
| D�������ڿ�����ȼ�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com