
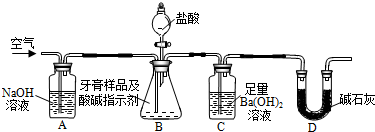
| 3.94g |
| 197g/mol |
| 2g |
| 8g |


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热NH4HCO3至熔融状态:NH4HCO3═NH4++HCO3? |
| B、CO2通入水中得到H2CO3:H2CO3═2H++CO32? |
| C、醋酸钠溶于水:CH3COONa═CH3COO-+Na+ |
| D、C2H5OH溶于水:C2H5OH═C2H5++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第17、18列都是非金属元素 |
| B、第1列元素和第17列元素的单质熔、沸点变化趋势相反 |
| C、只有第2列元素原子最外层有2个电子 |
| D、在18列元素中,第3列元素种类最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
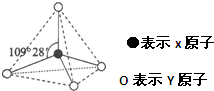
 已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大.元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同.
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大.元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com