
 .
. .
.

科目:高中化学 来源: 题型:
| A、5:1 | B、1:5 |
| C、3:7 | D、7:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
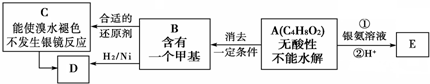
查看答案和解析>>
科目:高中化学 来源: 题型:
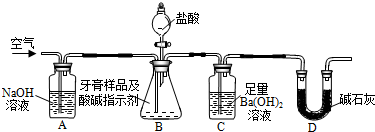
查看答案和解析>>
科目:高中化学 来源: 题型:
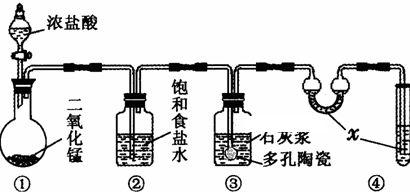
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验 | 操作 |
| A | 钠与水反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 证明某溶液中含Fe2+ | 取少量该溶液先加入氯水,再滴加KSCN溶液 |
| D | 取出分液漏斗中的上层液体 | 下层液体从分液漏斗下端管口放出,及时关闭活塞,换一个接收容器,上层液体从分液漏斗上口倒出 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A、L、M的单质与稀硫酸反应速率:M>L |
| B、T、Q的氢化物常态下均为无色气体 |
| C、R是非金属元素 |
| D、M3+是同周期简单离子中半径最小的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
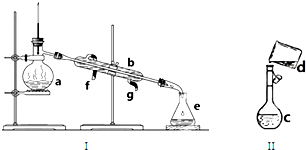
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、H+、SO42-、HCO3- |
| B、Cu2+、K+、SO42-、NO3- |
| C、Na+、K+、Cl-、NO3- |
| D、Mg2+、K+、SO42-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com