
ΓΨΧβΡΩΓΩΗΏΧζΥαΦΊΘ®K2FeO4Θ© «“Μ÷÷ΗΏ–ßΨΜΥ°ΦΝΓΘ“―÷ΣΘΚK2FeO4“Ή»ή”ΎΥ°Θ§ΈΔ»ή”Ύ≈®KOH»ή“ΚΘΜ‘ΎΥα–‘Μρ÷––‘»ή“Κ÷–≤ΜΈ»Ε®Θ§‘Ύ0ΓΪ5ΓφΒΡ«ΩΦν–‘»ή“Κ÷–ΫœΈ»Ε®ΓΘΡ≥ Β―ι–ΓΉι”ϊ÷Τ±ΗΗΏΧζΥαΦΊ≤Δ≤βΕ®Τδ¥ΩΕ»ΓΘ
Δώ.÷Τ±ΗΗΏΧζΥαΦΊΘ®Φ–≥÷ΉΑ÷Ο¬‘Θ©
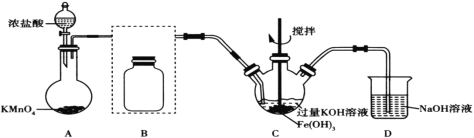
Θ®1Θ©ΉΑ÷ΟAΈΣ¬»ΤχΖΔ…ζΉΑ÷ΟΘ§Τδ÷– ΔΖ≈ΗΏΟΧΥαΦΊΒΡ“«ΤςΟϊ≥ΤΈΣ__ΓΘ
Θ®2Θ©ΫΪ≥ΐ‘”ΉΑ÷ΟB≤Ι≥δΆξ’ϊ≤Δ±ξΟςΥυ”Ο ‘ΦΝ__ΓΘ
Θ®3Θ©ΉΑ÷ΟC÷–Cl2”κFe(OH)3ΓΔKOHΖ¥”Π…ζ≥…K2FeO4ΒΡΜ·―ßΖΫ≥Χ Ϋ «____ΓΘ
Θ®4Θ© Β―ι ±ΫΪΉΑ÷ΟC÷Ο”Ύ±υΥ°‘Γ÷–Θ§Τδ‘≠“ρ «____ΓΘ
Θ®5Θ© Β―ιΚσΨ≠ΫαΨßΖ®ΒΟΒΫΒΡK2FeO4ΨßΧε»‘Κ§ΫœΕύ‘”÷ Θ§“ΣΒΟΒΫΗϋ¥ΩΒΡΨßΧεΘ§ΜΙ”Π≤…»ΓΒΡ≤ΌΉςΖΫΖ® «____ΓΘ
Δρ.≤βΕ®≤ζΤΖ¥ΩΕ»
Θ®6Θ©ΫΪwg K2FeO4¥÷≤ζΤΖ»ή”ΎΙΐΝΩΒΡΦν–‘―«ΗθΥα―Έ»ή“Κ÷–Θ§≥δΖ÷Ζ¥”ΠΚσΘ§Φ”»κœΓΝρΥαΥαΜ·÷ΝpHΈΣ2Θ§‘ΎΥυΒΟΒΡ÷ΊΗθΥα―Έ»ή“Κ÷–Φ”»κ5ΒΈΕΰ±ΫΑΖΜ«ΥαΡΤ»ή“ΚΉς÷Η ΨΦΝΘ§»ΜΚσ”Οc molΓΛL1(NH4)2Fe(SO4)2±ξΉΦ»ή“ΚΒΈΕ®÷Ν÷’ΒψΘ§œϊΚΡ±ξΉΦ»ή“ΚVmLΓΘ“―÷ΣΗΟΙΐ≥Χ÷–…φΦΑΒΡάκΉ”Ζ¥”Π÷ς“Σ”–»ΐΗωΘΚ
ΔΌCr(OH)4+ FeO42-=Fe(OH)3Γΐ+CrO42-+OHΘ§
ΔΎ_______Θ§
ΔέCr2O72-+6Fe2++ 14H+=6Fe3+ +2Cr3+ +7H2OΓΘ
ΗΟ¥÷≤ζΤΖ÷–K2FeO4ΒΡ÷ ΝΩΖ÷ ΐΈΣ__Θ®”ΟΚ§wΓΔcΓΔVΒΡ¥ζ ΐ Ϋ±μ ΨΘ©ΓΘ»τΒΈΕ®ΙήΟΜ”–”Ο±ξΉΦ“Κ»σœ¥Θ§‘ρ≤βΒΟΒΡΫαΙϊ__Θ®ΧνΓΑΤΪΗΏΓ±ΓΑΤΪΒΆΓ±ΜρΓΑΈό”ΑœλΓ±Θ©ΓΘ
ΓΨ¥πΑΗΓΩ‘≤ΒΉ…’ΤΩ  3Cl2ΘΪ2Fe(OH)3ΘΪ10KOH=2K2FeO4ΘΪ6KClΘΪ8H2O K2FeO4‘Ύ0ΓΪ5ΓφΜΖΨ≥÷–ΫœΈ»Ε®Θ§Ζά÷ΙΗ±Ζ¥”ΠΖΔ…ζ ÷ΊΫαΨß 2CrO42Θ≠ΘΪ2HΘΪ
3Cl2ΘΪ2Fe(OH)3ΘΪ10KOH=2K2FeO4ΘΪ6KClΘΪ8H2O K2FeO4‘Ύ0ΓΪ5ΓφΜΖΨ≥÷–ΫœΈ»Ε®Θ§Ζά÷ΙΗ±Ζ¥”ΠΖΔ…ζ ÷ΊΫαΨß 2CrO42Θ≠ΘΪ2HΘΪ![]() Cr2O72Θ≠ΘΪH2O
Cr2O72Θ≠ΘΪH2O ![]() Μρ
Μρ![]() Μρ
Μρ![]() ΤΪΗΏ
ΤΪΗΏ
ΓΨΫβΈωΓΩ
Δώάϊ”Ο≈®―ΈΥαΚΆKMnO4÷Τ±ΗCl2Θ§÷Τ±ΗΒΡCl2≥ΘΚ§”–HClΘ§–η“Σ”Ο±ΞΚΆ ≥―ΈΥ°≥ΐ‘”Θ§Cl2ΓΔFe(OH)3ΚΆKOHΖ¥”Π…ζ≥…K2FeO4Θ§άϊ”ΟNaOH»ή“Κ¥ΠάμΕύ”ύΒΡCl2ΓΘ
(1)ΗυΨί“«ΤςΒΡΫαΙΙΘ§Ω…÷ΣΗΟ“«ΤςΈΣ‘≤ΒΉ…’ΤΩΘΜ
(2)ΉΑ÷ΟBΒΡΉς”Ο «≥ΐ»ΞCl2÷–ΒΡHClΘ§―ÔϱΞΚΆ ≥―ΈΥ°Θ§ΉΑ÷Ο»γΆΦΥυ Ψ ΘΜ
ΘΜ
(3)Cl2÷–ClΒΡΜ·ΚœΦέΫΒΒΆΘ§¥”0ΫΒΒΆΒΫΘ≠1Θ§Ι≤ΫΒΒΆ2ΦέΘ§Fe(OH)3÷–FeΒΡΜ·ΚœΦέ…ΐΗΏΘ§¥”ΘΪ3…ΐΗΏΒΫΘΪ6Θ§Μ·ΚœΦέ…ΐΫΒ ΊΚψΘ§‘ρCl2ΚΆFe(OH)3ΒΡœΒ ΐ±»ΈΣ3ΘΚ2Θ§‘ΌΗυΨί‘≠Ή” ΊΚψ≈δΤΫΘ§Μ·―ßΖΫ≥Χ ΫΈΣ3Cl2ΘΪ2Fe(OH)3ΘΪ10KOH=2K2FeO4ΘΪ6KClΘΪ8H2OΘΜ
(4)≤ζΈοK2FeO4‘Ύ0ΓΪ5ΓφΒΡ«ΩΦν–‘»ή“Κ÷–ΫœΈ»Ε®Θ§“ρ¥ΥΫΪΉΑ÷ΟC÷Ο”Ύ±υΥ°‘Γ÷– «K2FeO4‘Ύ0ΓΪ5ΓφΜΖΨ≥÷–ΫœΈ»Ε®Θ§Ζά÷ΙΗ±Ζ¥”ΠΖΔ…ζΘΜ
(5)K2FeO4“Ή»ή”ΎΥ°÷–Θ§ΫαΨßΚσΒΡK2FeO4÷–Κ§”–ΫœΕύ‘”÷ Θ§Ω…“‘άϊ”Ο÷ΊΫαΨßΧα¥ΩΘΜ
Δρ(6)ΗυΨίΖ¥”ΠΔΌΚΆΔέΘ§Φ”»κH2SO4ΥαΜ·ΚσΘ§Ζ¥”ΠΔΌ÷–ΒΡ≤ζΈοCrO42Θ≠ΉΣΜ·ΈΣCr2O72Θ≠Θ§άκΉ”ΖΫ≥ΧΈΣ2CrO42Θ≠ΘΪ2HΘΪCr2O72Θ≠ΘΪH2OΘΜ
ΗυΨίΖ¥”ΠΖΫ≥Χ ΫΘ§Ω…ΒΟΙΊœΒ ΫK2FeO4ΓΪCrO42Θ≠ΓΪ![]() Cr2O72Θ≠ΓΪ3Fe2ΘΪΘ§n(K2FeO4)=
Cr2O72Θ≠ΓΪ3Fe2ΘΪΘ§n(K2FeO4)=![]() n[(NH4)2Fe(SO4)2]=
n[(NH4)2Fe(SO4)2]=![]() ΓΝcVΓΝ10Θ≠3molΘ§m(K2FeO4)=
ΓΝcVΓΝ10Θ≠3molΘ§m(K2FeO4)=![]() ΓΝcVΓΝ10Θ≠3molΓΝ198gΓΛmolΘ≠1=0.066cVgΘ§‘ρK2FeO4ΒΡ÷ ΝΩΖ÷ ΐΈΣ
ΓΝcVΓΝ10Θ≠3molΓΝ198gΓΛmolΘ≠1=0.066cVgΘ§‘ρK2FeO4ΒΡ÷ ΝΩΖ÷ ΐΈΣ![]() ΘΜ
ΘΜ
»γΙϊΒΈΕ®ΙήΟΜ”–”Ο±ξΉΦ“Κ»σœ¥Θ§Ρ«Ο¥œϊΚΡΒΡ±ξΉΦ“ΚΒΡΧεΜΐΜα‘ωΦ”Θ§ΦΤΥψΒΟΒΫK2FeO4ΒΡ÷ ΝΩΜα‘ωΦ”Θ§÷ ΝΩΖ÷ ΐΤΪΗΏΓΘ



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
A.≥ΘΈ¬œ¬Θ§ΫΪ![]() ΒΡ¥ΉΥα»ή“ΚœΓ ΆΒΫ‘≠ΧεΜΐΒΡ10±ΕΚσΘ§»ή“ΚΒΡ
ΒΡ¥ΉΥα»ή“ΚœΓ ΆΒΫ‘≠ΧεΜΐΒΡ10±ΕΚσΘ§»ή“ΚΒΡ![]()
B.≥ΘΈ¬œ¬Θ§»τNaHA»ή“ΚΒΡ![]() Θ§‘ρ
Θ§‘ρ![]() «»θΥα
«»θΥα
C.”Ο―ΈΥα±ξΉΦ»ή“ΚΒΈΕ®Α±Υ°÷Ν÷––‘ ±Θ§![]() Έ¥±ΜΆξ»Ϊ÷–ΚΆ
Έ¥±ΜΆξ»Ϊ÷–ΚΆ
D.![]() ±
±![]() »ή“ΚΒΡ
»ή“ΚΒΡ![]() ¥σ”Ύ
¥σ”Ύ![]() ±NaCl»ή“ΚΒΡ
±NaCl»ή“ΚΒΡ![]()
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΑ¥“Σ«σΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©œ÷”–“‘œ¬Έο÷ ΘΚΔΌNaClΨßΧε ΔΎ“ΚΧ§HCl ΔέCaCO3ΙΧΧε Δή»έ»ΎKCl Δί’αΧ« ΔόΆ≠ ΔΏCO2 ΔύH2SO4 ΔαKOHΙΧΧε
a. “‘…œΈο÷ ÷–ΡήΒΦΒγΒΡ «________________________________ΓΘ
b. “‘…œΈο÷ ÷– τ”ΎΒγΫβ÷ ΒΡ «_______________________Θ§ τ”ΎΖ«ΒγΫβ÷ ΒΡ «_______________________ΓΘ
c. “‘…œΈο÷ ÷–Θ§»ή”ΎΥ°«“ΡήΒΦΒγΒΡΈο÷ «_______________________ΓΘ
Θ®2Θ©ΫΚΧεΚΆ»ή“ΚΒΡ±Ψ÷ «χ±π «________________Θ§Φχ±πΫΚΧεΚΆ»ή“ΚΥυ≤…”ΟΒΡΖΫΖ® «Ιέ≤λ «ΖώΡήΖΔ…ζ___________–ß”ΠΓΘ
Θ®3Θ©œ¬Ν–3ΗωΖ¥”ΠΘ§Α¥“Σ«σΧν–¥œύΙΊΝΩΓΘ
ΔΌ2Na2O2+2H2OΘΫ4NaOH+ O2ΓϋΖ¥”Π÷–Θ§ΟΩœϊΚΡ1 mol Na2O2…ζ≥…_____ g O2ΓΘ
ΔΎ‘ΎNaHCO3ΒΡ»»Ζ÷ΫβΖ¥”Π÷–Θ§ΟΩœϊΚΡ168 g NaHCO3Θ§±ξΉΦΉ¥Ωωœ¬…ζ≥…_____L CO2ΓΘ
ΔέCl2+H2OΘΫHCl+HClOΖ¥”Π÷–Θ§±ξΉΦΉ¥Ωωœ¬ΟΩœϊΚΡ22.4LCl2Θ§ΉΣ“Τ_____molΒγΉ”ΓΘ
Θ®4Θ©‘Ύ“ΜΗωΟή±’»ίΤς÷–Ζ≈»κ“‘œ¬ΥΡ÷÷Έο÷ Θ§‘Ύ“ΜΕ®ΧθΦΰœ¬ΖΔ…ζΜ·―ßΖ¥”ΠΘ§“ΜΕΈ ±ΦδΚσΘ§≤βΒΟ”–ΙΊ ΐΨί»γœ¬ΘΚ
Έο÷ | M | N | Q | P |
Ζ¥”Π«Α÷ ΝΩΘ®gΘ© | 50 | 1 | 3 | 12 |
Ζ¥”ΠΚσ÷ ΝΩΘ®gΘ© | x | 26 | 3 | 30 |
ΔΌΗΟ±δΜ·ΒΡΜυ±ΨΖ¥”Πάύ–Ά «_____Ζ¥”ΠΘΜ
ΔΎΈο÷ Q‘ΎΖ¥”Π÷–ΤπΒΡΉς”Ο «_____ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥Μ·―ß–Υ»Λ–ΓΉιΒΡΆ§―ß…ηΦΤΝΥ»γΆΦΥυ ΨΒΡΉΑ÷ΟΘ§Άξ≥…œ¬Ν–Έ ΧβΘΚ
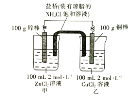
Θ®1Θ©Ζ¥”ΠΙΐ≥Χ÷–Θ§______Ατ÷ ΝΩ‘ωΦ”ΓΘ
Θ®2Θ©ΉήΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ_____ΓΘ
Θ®3Θ©Ζ¥”Π÷–Θ§Β±Τδ÷–“ΜΗωΒγΦΪ÷ ΝΩ±δΈΣ102g ±Θ§Νμ“ΜΒγΦΪ÷ ΝΩ______________Θ®Χν¥σ”ΎΓΔ–Γ”ΎΜρΒ»”ΎΘ©98gΓΘ
Θ®4Θ©Ζ¥”ΠΙΐ≥Χ÷–Θ§―Έ«≈÷–ΒΡ________ άκΉ”Ϋχ»κΦΉ±≠ΓΘ
Θ®5Θ©Β±ΆβΒγ¬Ζ÷–ΉΣ“Τ0.2molΒγΉ” ±Θ§““…’±≠÷–≈®Ε»Ήν¥σΒΡ―τάκΉ” «_________Θ§ΤδΈο÷ ΒΡΝΩ≈®Ε»ΈΣ_______________ΓΘΘ®ΦΌ…η»ή“ΚΧεΜΐ≤Μ±δΘ©
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ(1)12.4 g Na2RΚ§NaΘΪ0.4 molΘ§‘ρNa2RΒΡΡΠΕϊ÷ ΝΩΈΣ________Θ§RΒΡœύΕ‘‘≠Ή”÷ ΝΩΈΣ________ΓΘΚ§RΒΡ÷ ΝΩΈΣ1.6 gΒΡNa2RΘ§ΤδΈο÷ ΒΡΝΩΈΣ________ΓΘ
(2)86.4gAΒΞ÷ ”κ4.80molCl2Άξ»ΪΖ¥”ΠΘ§…ζ≥…3.20molAClx,‘ρx=___________Θ§AΒΡΡΠΕϊ÷ ΝΩΈΣ__________________gΓΛmol-1
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷ΣA «“Μ÷÷≥ΘΦϊΒΡ“Μ÷÷Ϋπ τΘ§F «“Μ÷÷ΚλΚ÷…ΪΒΡ≥ΝΒμΓΘ ‘ΗυΨίΆΦ÷–ΉΣΜ·ΙΊœΒΘ§ΜΊ¥πœ¬Ν–Έ ΧβΓΘ
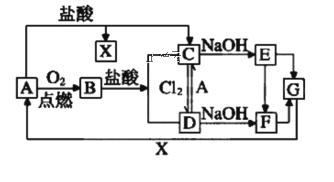
Θ®1Θ©–¥≥ωAΓΔBΓΔDΓΔEΒΡΜ·―ß ΫΘΚA___ΓΔB___ΓΔD___ΓΔE___ΓΘ
Θ®2Θ©Φλ―ιD÷–―τάκΉ”ΒΡΖΫΖ®ΘΚ___ΓΘ
Θ®3Θ©±Θ¥φC»ή“Κ ±ΈΣ ≤Ο¥Φ”ΙΧΧεA___ΓΘ
Θ®4Θ©–¥≥ωœ¬Ν–ΉΣΜ·ΒΡάκΉ”ΖΫ≥Χ Ϋ
ΔΌCΓζE___ΓΘ
ΔΎAΓζC___ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩH3AsO3 «“Μ÷÷ΨγΕΨΈοΘ§Ω…Φ”»κλνΕΨΦΝSnCl2ά¥≥ΐ»ΞΘ§Ζ¥”ΠΖΫ≥Χ ΫΈΣΘΚ2H3AsO3+3SnCl2+12X=2AsΓΐ+3H2SnCl6+6H2OΓΘœ¬Ν–ΙΊ”ΎΗΟΖ¥”ΠΒΡΥΒΖ®÷–’ΐ»ΖΒΡ «Θ® Θ©
A.ΜΙ‘≠ΦΝ «H3AsO3
B.XΒΡΜ·―ß ΫΈΣHClΘ§ «ΗΟΖ¥”ΠΒΡ―θΜ·ΦΝ
C.ΟΩ…ζ≥…0.2molAsΘ§ΜΙ‘≠ΦΝΒΟΒΫ0.6molΒγΉ”
D.ΗΟΖ¥”ΠΉΣ“Τ2molΒγΉ”Θ§‘ρœϊΚΡλνΕΨΦΝSnCl2ΈΣ1mol
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ«κΑ¥“Σ«σΉς¥πΘΚ
(1)«κΗυΨίΙΌΡήΆ≈ΒΡ≤ΜΆ§Ε‘œ¬Ν–”–ΜζΈοΫχ––Ζ÷άύΘΚ
ΔΌ ![]() ΔΎ
ΔΎ ![]() Δέ
Δέ ![]() Δή
Δή ![]()
Δί ![]() Δό
Δό![]() ΔΏ
ΔΏ![]()
Δώ.Ζ”ΘΚ________ΆΣΘΚ________»©ΘΚ________(Χν–ρΚ≈)ΘΜ
Δρ.ΔήΒΡΙΌΡήΆ≈ΒΡΟϊ≥ΤΈΣ______ΓΔΔΏΒΡΙΌΡήΆ≈ΒΡΟϊ≥ΤΈΣ______ΘΜ
(2)Ζ÷Ή” ΫΈΣC4H8«“ τ”Ύœ©ΧΰΒΡ”–ΜζΈοΒΡΆ§Ζ÷“λΙΙΧεΘ®≤ΜΩΦ¬«Υ≥Ζ¥“λΙΙΘ©”– ____÷÷ΘΜ ΗΏΨέΈοΒΡΒΞΧεΒΡΫαΙΙΦρ Ϋ «_________ΓΘ
ΗΏΨέΈοΒΡΒΞΧεΒΡΫαΙΙΦρ Ϋ «_________ΓΘ
(3)![]() ΒΡΟϊ≥ΤΈΣΘΚ_____________ΘΜ–¥≥ω
ΒΡΟϊ≥ΤΈΣΘΚ_____________ΘΜ–¥≥ω![]() ΨέΚœ…ζ≥…ΗΏΖ÷Ή”Μ·ΚœΈοΒΡΜ·―ßΖΫ≥Χ Ϋ__________________________________ΘΜ
ΨέΚœ…ζ≥…ΗΏΖ÷Ή”Μ·ΚœΈοΒΡΜ·―ßΖΫ≥Χ Ϋ__________________________________ΘΜ
(4)ΦϋœΏ Ϋ![]() ±μ ΨΒΡΖ÷Ή” ΫΈΣ___________ΘΜ”κΤδΜΞΈΣΆ§Ζ÷“λΙΙΧε«““Μ¬»¥ζΈο”–ΝΫ÷÷ΒΡΧΰΒΡΫαΙΙΦρ Ϋ____________________ΘΜ
±μ ΨΒΡΖ÷Ή” ΫΈΣ___________ΘΜ”κΤδΜΞΈΣΆ§Ζ÷“λΙΙΧε«““Μ¬»¥ζΈο”–ΝΫ÷÷ΒΡΧΰΒΡΫαΙΙΦρ Ϋ____________________ΘΜ
(5)άΚΆιΖ÷Ή”ΒΡΫαΙΙ»γΆΦΥυ ΨΘΚ
![]()
ΔΌάΚΆιΒΡΖ÷Ή” ΫΈΣΘΚ________,Τδ“Μ¬»¥ζΈο”–______÷÷ΘΜ
ΔΎ»τ Ι1molΗΟΧΰΒΡΥυ”–«β‘≠Ή”»Ϊ≤Ω±Μ¬»‘≠Ή”»Γ¥ζΘ§–η“Σ_____mol¬»ΤχΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩPbCrO4 «“Μ÷÷ΜΤ…Ϊ―’ΝœΘ§÷Τ±ΗPbCrO4ΒΡ“Μ÷÷ Β―ι≤Ϋ÷η»γΆΦ1ΘΚ
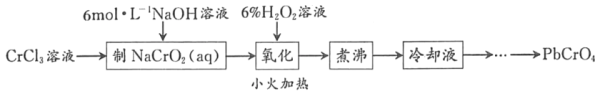
“―÷ΣΘΚΔΌCrΘ®OHΘ©3Θ®ΝΫ–‘«β―θΜ·ΈοΘ©≥ ¬Χ…Ϊ«“Ρ―»ή”ΎΥ°
ΔΎPbΘ®NO3Θ©2ΓΔPbΘ®CH3COOΘ©2Ψυ“Ή»ή”ΎΥ°Θ§PbCrO4ΒΡKspΈΣ2.8ΓΝ10©¹13Θ§PbΘ®OHΘ©2ΩΣ Φ≥ΝΒμ ±pHΈΣ7.2Θ§Άξ»Ϊ≥ΝΒμ ±pHΈΣ8.7ΓΘ
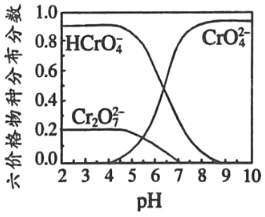
ΔέΝυΦέΗθ‘Ύ»ή“Κ÷–Έο÷÷Ζ÷≤ΦΖ÷ ΐ”κpHΙΊœΒ»γΆΦ2Υυ ΨΓΘ
ΔήPbCrO4Ω…”…Ζ–ΧΎΒΡΗθΥα―Έ»ή“Κ”κ«Π―Έ»ή“ΚΉς”Ο÷ΤΒΟΘ§Κ§PbCrO4Ψß÷÷ ±Ηϋ“Ή…ζ≥…
Θ®1Θ© Β―ι ±–η“Σ≈δ÷Ο100mL3molL©¹1CrCl3»ή“ΚΘ§œ÷”–ΝΩΆ≤ΓΔ≤ΘΝßΑτΓΔ…’±≠Θ§ΜΙ–η“Σ≤ΘΝß“«Τς «___ΓΘ
Θ®2Θ©ΓΑ÷ΤNaCrO2Θ®aqΘ©Γ± ±Θ§ΩΊ÷ΤNaOH»ή“ΚΦ”»κΝΩΒΡ≤ΌΉςΖΫΖ® «_____ΓΘ
Θ®3Θ©ΓΑ―θΜ·Γ± ±H2O2ΒΈΦ”ΥΌΕ»≤Μ“ΥΙΐΩλΘ§Τδ‘≠“ρ «_____ΘΜΓΑ―θΜ·Γ± ±ΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ___ΓΘ
Θ®4Θ©ΓΑ÷σΖ–Γ±ΒΡΡΩΒΡ «_____ΓΘ
Θ®5Θ©«κ…ηΦΤ”ΟΓΑά以“ΚΓ±÷Τ±ΗPbCrO4ΒΡ Β―ι≤ΌΉςΘΚ_____[ Β―ι÷––κ Ι”ΟΒΡ ‘ΦΝ”–ΘΚ6molL©¹1ΒΡ¥ΉΥαΘ§0.5molL©¹1PbΘ®NO3Θ©2»ή“ΚΘ§pH ‘÷Ϋ]ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com