
【题目】下列说法正确的是
A.常温下,将![]() 的醋酸溶液稀释到原体积的10倍后,溶液的
的醋酸溶液稀释到原体积的10倍后,溶液的![]()
B.常温下,若NaHA溶液的![]() ,则
,则![]() 是弱酸
是弱酸
C.用盐酸标准溶液滴定氨水至中性时,![]() 未被完全中和
未被完全中和
D.![]() 时
时![]() 溶液的
溶液的![]() 大于
大于![]() 时NaCl溶液的
时NaCl溶液的![]()
科目:高中化学 来源: 题型:
【题目】以熔融的碳酸盐(K2CO3)为电解液,泡沫镍为电极,氧化纤维布为隔膜(仅允许阴离子通过)可构成直接碳燃料电池,其结构如图所示,下列说法正确的是
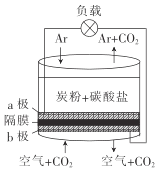
A.该电池工作时,CO32-通过隔膜移动到b极
B.若a极消耗1mol碳粉,转移电子数为4NA
C.b极的电极反应式为2CO2+O2-4e-=2CO32-
D.为使电池持续工作,理论上需要补充K2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列判断正确的是( )
A.1mol N2含有的原子数目为NA
B.24gMg变为Mg2+时失去的电子数目为2NA
C.1 molL﹣1CaCl2溶液中含有的Cl﹣数目为2NA
D.常温常压下,11.2LCO2中含有的原子数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O(g)=CO(g)ΔH1 ; C(s)+![]() O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2
②S(s)+O2 (g)=SO2 (g) ΔH3 ; S(g)+O2 (g)=SO2 (g) ΔH4
③H2(g)+ ![]() O2(g)=H2O(l) ΔH5;2H2(g)+O2(g)=2H2O(l) ΔH6
O2(g)=H2O(l) ΔH5;2H2(g)+O2(g)=2H2O(l) ΔH6
④CaCO3(s)=CaO(s)+CO2(g) ΔH7;CaO(s)+H2O(l)=Ca(OH)2(s) ΔH8
A. ①B. ④C. ②③④D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是
A.溴乙烷发生消去反应:![]()
B.向![]() 溶液中加入过量氨水:
溶液中加入过量氨水:![]()
C.向![]() 溶液中加入过量
溶液中加入过量![]() 溶液:
溶液:![]()
D.向含![]() 和KOH均为0.1 mol的混合溶液中通人标准状况下4.48 L
和KOH均为0.1 mol的混合溶液中通人标准状况下4.48 L![]() 气体:
气体:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象与对应化学方程式都正确的是( )
A.向Na2SiO3溶液中加入稀盐酸,边加边振荡,有硅酸胶体产生;Na2SiO3+2HCl=H2SiO3+2NaCl
B.氢气在氯气中安静的燃烧,发出淡蓝色火焰,瓶口出现白雾;H2+Cl2![]() 2HCl
2HCl
C.FeSO4溶液中加入NaOH溶液时,生成的白色絮状沉淀迅速变为灰绿色,最后变成红褐色;2Fe(OH)2+O2+H2O=2Fe(OH)3
D.钠投入水中,浮在水面熔成小球,在水面快速移动,得到的溶液显碱性;2Na+2H2O=2NaOH+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 异戊烷的一溴代物和1,2—二甲基环己烷的一溴代物都有4种(不考虑立体异构)
B. CH3CH=CHCH3分子中的所有原子在同一平面上
C. 按系统命名法,化合物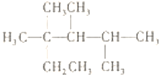 的名称是2,3,4-三甲基-2-乙基戊烷
的名称是2,3,4-三甲基-2-乙基戊烷
D. 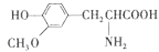 与
与![]() 二者互为同系物
二者互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓H2SO4(密度为1.84 g/mL)配制1 mol·L-1的稀H2SO4100mL,配制过程中可能用到下列仪器:
①100mL量筒;②10mL量筒;③50mL烧杯;④托盘天平;⑤100mL容量瓶;⑥胶头滴管;⑦玻璃棒。按使用出现的先后顺序排列正确的是
A. ②⑥③⑦⑤ B. ④③⑤⑦⑥ C. ①③⑦⑤⑥ D. ②⑤⑦⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种高效净水剂。已知:K2FeO4易溶于水,微溶于浓KOH溶液;在酸性或中性溶液中不稳定,在0~5℃的强碱性溶液中较稳定。某实验小组欲制备高铁酸钾并测定其纯度。
Ⅰ.制备高铁酸钾(夹持装置略)
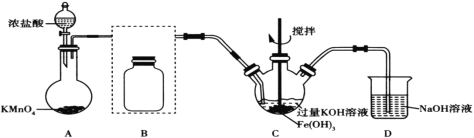
(1)装置A为氯气发生装置,其中盛放高锰酸钾的仪器名称为__。
(2)将除杂装置B补充完整并标明所用试剂__。
(3)装置C中Cl2与Fe(OH)3、KOH反应生成K2FeO4的化学方程式是____。
(4)实验时将装置C置于冰水浴中,其原因是____。
(5)实验后经结晶法得到的K2FeO4晶体仍含较多杂质,要得到更纯的晶体,还应采取的操作方法是____。
Ⅱ.测定产品纯度
(6)将wg K2FeO4粗产品溶于过量的碱性亚铬酸盐溶液中,充分反应后,加入稀硫酸酸化至pH为2,在所得的重铬酸盐溶液中加入5滴二苯胺磺酸钠溶液作指示剂,然后用c mol·L1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液VmL。已知该过程中涉及的离子反应主要有三个:
①Cr(OH)4+ FeO42-=Fe(OH)3↓+CrO42-+OH,
②_______,
③Cr2O72-+6Fe2++ 14H+=6Fe3+ +2Cr3+ +7H2O。
该粗产品中K2FeO4的质量分数为__(用含w、c、V的代数式表示)。若滴定管没有用标准液润洗,则测得的结果__(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com