
【题目】下列方程式书写正确的是
A.溴乙烷发生消去反应:![]()
B.向![]() 溶液中加入过量氨水:
溶液中加入过量氨水:![]()
C.向![]() 溶液中加入过量
溶液中加入过量![]() 溶液:
溶液:![]()
D.向含![]() 和KOH均为0.1 mol的混合溶液中通人标准状况下4.48 L
和KOH均为0.1 mol的混合溶液中通人标准状况下4.48 L![]() 气体:
气体:![]()
【答案】D
【解析】
A.溴乙烷在NaOH乙醇溶液中发生消去反应:CH3CH2Br![]() CH2=CH2↑+HBr,故A错误;
CH2=CH2↑+HBr,故A错误;
B.硫酸铜溶液中加过量的氨水的离子反应为Cu2++4NH3H2O═[Cu(NH3)4]2++4H2O,故B错误;
C.FeCl3溶液中加入过量Na2S溶液,反应生成硫化亚铁、硫单质,正确的离子方程式为:2Fe3++3S2-=2FeS↓+S↓,故C错误;
D.向含Ba(OH)2和KOH均为0.1mol的混合溶液中通入标准状况下4.48LCO2气体即0.2mol二氧化碳,其中的0.1mol二氧化碳先和0.1molBa(OH)2反应生成0.1molBaCO3,剩余的0.1mol二氧化碳再和0.1molKOH反应生成KHCO3,故离子方程式为Ba2++3OH-+2CO2═BaCO3↓+HCO3-+H2O,故D正确;
故选:D。


科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2(g)![]() 2NO(g)+ O2(g) 在体积不变的密闭容器中进行,达到平衡状态的标志是( )
2NO(g)+ O2(g) 在体积不变的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
A. ①④ B. ②③⑤ C. ①③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,均含有相同的某种元素,在一定条件下,它们之间具有如下转化关系:甲![]() 乙
乙![]() 丙
丙![]() 丁。下列有关物质的推断不正确的是( )
丁。下列有关物质的推断不正确的是( )
A.若甲为C,则乙可能是CO
B.若甲为S,则丁可能是H2SO4
C.若甲为Na,则丙可能是Na2O2
D.若甲为Fe,则丁可能是Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) H1=-890.3kJ·mol-1
CO(g)+![]() O2(g)=CO(g) H2=-283.0kJ·mol-1
O2(g)=CO(g) H2=-283.0kJ·mol-1
H2(g)+![]() O2(g)=H2O(l) H3=-285.8kJmol-1
O2(g)=H2O(l) H3=-285.8kJmol-1
CO(g)+H2O(g)=CO2(g)+H2(g) H4=-41.0kJmol-1
则甲烷水蒸气重整反应的△H=__kJ·mol-1。
(2)通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2的物质的量分数与水碳比、平衡温度的关系如图所示。
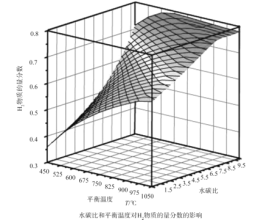
①H2的物质的量分数与水碳比(1~10)的关系是平衡温度一定时,__;其原因是__。
②据模拟实验可知,平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,CH4的转化率为__,其压强平衡常数为__;反应速率方程为v=kp(CH4)p-1(H2),此时反应速率=__(已知:气体分压=气体的物质的量分数×总压,速率方程中k为速率常数)。
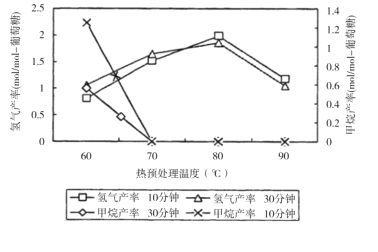
(3)厌氧细菌可将葡萄糖转化为CH4和H2,pH为5.5时不同热预处理温度和时间下的甲烷和氢气的产率如图所示,若要提高H2的产率,最佳温度为__;与甲烷水蒸气重整制氢相比其优点有__(至少写两点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应的反应速率最快的是
3C(g)+4D(g)反应中,表示该反应的反应速率最快的是
A.v(A)=0.5 mol·L1·min 1B.v(B)=0.1 mol·L1·s1
C.v(C)=0.8 mol·L1·min 1D.v(D)=1 mol·L1·min 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.常温下,将![]() 的醋酸溶液稀释到原体积的10倍后,溶液的
的醋酸溶液稀释到原体积的10倍后,溶液的![]()
B.常温下,若NaHA溶液的![]() ,则
,则![]() 是弱酸
是弱酸
C.用盐酸标准溶液滴定氨水至中性时,![]() 未被完全中和
未被完全中和
D.![]() 时
时![]() 溶液的
溶液的![]() 大于
大于![]() 时NaCl溶液的
时NaCl溶液的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
②CH3OH(g)+![]() O2(g)===CO2(g)+2H2O(g) ΔH=-192.9 kJ/mol
O2(g)===CO2(g)+2H2O(g) ΔH=-192.9 kJ/mol
由上述方程式可知:CH3OH的燃烧热________(填“大于”“等于”或“小于”)192.9 kJ/mol。
已知水的气化热为44 kJ/mol。则表示氢气燃烧热的热化学方程式为__________。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。
已知:①2NH3(g)+CO2(g)===NH2CO2NH4(s) ΔH=-159.5 kJ/mol
②NH2CO2NH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+116.5 kJ/mol
③H2O(l)===H2O(g) ΔH=+44.0 kJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式是_____________________________。
(3)已知:①Fe(s)+![]() O2(g)===FeO(s) ΔH1=-272.0 kJ/mol
O2(g)===FeO(s) ΔH1=-272.0 kJ/mol
②2Al(s)+![]() O2(g)===Al2O3(s) ΔH2=-1675.7 kJ/mol
O2(g)===Al2O3(s) ΔH2=-1675.7 kJ/mol
Al和FeO发生铝热反应的热化学方程式是_____________________________________。该反应的自发性趋势很大,原因是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是
A. 灼热的炭与CO2反应 B. 氧化铁与铝反应
C. 钠与乙醇反应 D. Ba(OH)2·8H2O与NH4C1反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)12.4 g Na2R含Na+0.4 mol,则Na2R的摩尔质量为________,R的相对原子质量为________。含R的质量为1.6 g的Na2R,其物质的量为________。
(2)86.4gA单质与4.80molCl2完全反应,生成3.20molAClx,则x=___________,A的摩尔质量为__________________g·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com