
【题目】甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) H1=-890.3kJ·mol-1
CO(g)+![]() O2(g)=CO(g) H2=-283.0kJ·mol-1
O2(g)=CO(g) H2=-283.0kJ·mol-1
H2(g)+![]() O2(g)=H2O(l) H3=-285.8kJmol-1
O2(g)=H2O(l) H3=-285.8kJmol-1
CO(g)+H2O(g)=CO2(g)+H2(g) H4=-41.0kJmol-1
则甲烷水蒸气重整反应的△H=__kJ·mol-1。
(2)通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2的物质的量分数与水碳比、平衡温度的关系如图所示。
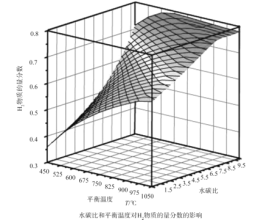
①H2的物质的量分数与水碳比(1~10)的关系是平衡温度一定时,__;其原因是__。
②据模拟实验可知,平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,CH4的转化率为__,其压强平衡常数为__;反应速率方程为v=kp(CH4)p-1(H2),此时反应速率=__(已知:气体分压=气体的物质的量分数×总压,速率方程中k为速率常数)。
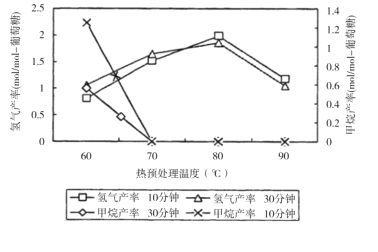
(3)厌氧细菌可将葡萄糖转化为CH4和H2,pH为5.5时不同热预处理温度和时间下的甲烷和氢气的产率如图所示,若要提高H2的产率,最佳温度为__;与甲烷水蒸气重整制氢相比其优点有__(至少写两点)。
【答案】+206.3 水碳比越大,H2的物质的量分数越大 水碳比较大时,CO会与H2O进一步反应生成H2,使H2的物质的量分数增大 66.67% 4.32×102(MPa)2 ![]() 80℃ 原料来源广、制取H2温度低、不会产生CO等有害气体等
80℃ 原料来源广、制取H2温度低、不会产生CO等有害气体等
【解析】
(1)用盖斯定律求甲烷水蒸气重整反应的△H;
(2)①H2的物质的量分数与水碳比(1~10)的关系由图知;原因从生成氢气的反应角度来回答;
②平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,CH4的转化率、其压强平衡常数;以及此时反应速率通过三段式计算;
(3)厌氧细菌可将葡萄糖转化为CH4和H2,提高H2的产率的最佳温度,由图知;与甲烷水蒸气重整制氢相比的优点从反应的难易程度及环保、经济等角度来考察。
(1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) H1=-890.3kJ·mol-1②CO(g)+![]() O2(g)=CO(g) H2=-283.0kJ·mol-1③H2(g)+
O2(g)=CO(g) H2=-283.0kJ·mol-1③H2(g)+![]() O2(g)=H2O(l) H3=-285.8kJmol-1④CO(g)+H2O(g)=CO2(g)+H2(g) H4=-41.0kJmol-1,根据盖斯定律,①+④2×②2×③即得甲烷水蒸气的重整反应方程式为CH4(g)+H2O(g)
O2(g)=H2O(l) H3=-285.8kJmol-1④CO(g)+H2O(g)=CO2(g)+H2(g) H4=-41.0kJmol-1,根据盖斯定律,①+④2×②2×③即得甲烷水蒸气的重整反应方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g),则甲烷水蒸气重整反应ΔH=ΔH1+ΔH42ΔH22ΔH3=(890.341+2×283.0+2×285.8) kJmol1=+206.3 kJmol1;
CO(g)+3H2(g),则甲烷水蒸气重整反应ΔH=ΔH1+ΔH42ΔH22ΔH3=(890.341+2×283.0+2×285.8) kJmol1=+206.3 kJmol1;
答案为:+206.3;
(2)①平衡温度一定时,H2的物质的量分数与水碳比(1~10)的关系,由图中曲线走势可知;
答案为:水碳比越大,H2的物质的量分数越大;
水碳比越大,H2的物质的量分数越大的原因,从生成氢气的反应可知,除了甲烷水蒸气的重整反应生成氢气外,一氧化碳和水也会反应产生氢气;
答案为:当水碳比较大时,CO会与H2O反应生成H2,使H2的物质的量分数增大;
②操作压强为0.1MPa、平衡温度为900℃条件下,水碳比为1.0时,H2的物质的量分数为0.6,设甲烷和H2O的物质的量均为amol,达化学平衡时,甲烷消耗x,
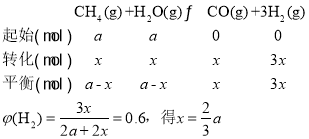 ,则CH4的转化率
,则CH4的转化率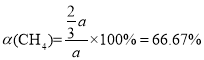
答案为:66.67%;
已知:气体分压=气体的物质的量分数×总压,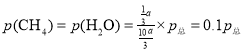
![]() ,
,![]() ,压强平衡常数为
,压强平衡常数为![]() ;
;
答案为:4.32×102(MPa)2;
反应速率方程为v=kp(CH4)p-1(H2),此时反应速率![]() ;
;
答案为:![]() ;
;
(3)厌氧细菌可将葡萄糖转化为CH4和H2,pH为5.5时,若要提高H2的产率,降低甲烷产率,最佳温度为80℃;与甲烷水蒸气重整制氢相比其优点有原料来源广、制取H2温度低、不会产生CO等有害气体等;
答案为:80℃;原料来源广、制取H2温度低、不会产生CO等有害气体等。


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】能充分说明可逆反应N2(g)+O2(g)![]() 2NO(g)已达到平衡状态的是( )
2NO(g)已达到平衡状态的是( )
A. 容器内压强不随时间改变
B. 容器内反应物总物质的量不随时间改变
C. 容器内气体N2、O2、NO的分子数之比为1:1:2
D. 单位时间内每消耗n mo1N2,同时生成2n mo1NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 H(结构简式为 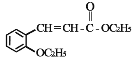 )是合成高分子化合物 M 的单体,H可以通过有机物A(分子式为 C7H8O)和丙酮为原料来进行合成,其合成路线如下:
)是合成高分子化合物 M 的单体,H可以通过有机物A(分子式为 C7H8O)和丙酮为原料来进行合成,其合成路线如下:
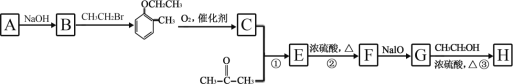
已知:① ![]()
②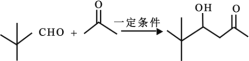
请回答下列问题:
(1)A结构简式为_____,C 中所含官能团的名称是_____;①和③的反应类型分别是_____。
(2)简述溴乙烷中溴原子检验方法_____。
(3)高分子化合物M 的结构简式为_____。
(4)反应③的化学反应方程式为_____。
(5)有机物 C 有多种同分异构体,其中苯环上只有两个侧链的芳香酯的同分异构体有_____种。
(6)设计由苯甲醛和 2-丙醇制备![]() 的合成路线_____(无机试剂任选)。
的合成路线_____(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列判断正确的是( )
A.1mol N2含有的原子数目为NA
B.24gMg变为Mg2+时失去的电子数目为2NA
C.1 molL﹣1CaCl2溶液中含有的Cl﹣数目为2NA
D.常温常压下,11.2LCO2中含有的原子数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用蒸馏水稀释0. 1mol/L的CH3COOH溶液时,始终保持增大趋势的是
A. c(CH3COOH)B. c(H+)C. c(CH3COO-)D. c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O(g)=CO(g)ΔH1 ; C(s)+![]() O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2
②S(s)+O2 (g)=SO2 (g) ΔH3 ; S(g)+O2 (g)=SO2 (g) ΔH4
③H2(g)+ ![]() O2(g)=H2O(l) ΔH5;2H2(g)+O2(g)=2H2O(l) ΔH6
O2(g)=H2O(l) ΔH5;2H2(g)+O2(g)=2H2O(l) ΔH6
④CaCO3(s)=CaO(s)+CO2(g) ΔH7;CaO(s)+H2O(l)=Ca(OH)2(s) ΔH8
A. ①B. ④C. ②③④D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是
A.溴乙烷发生消去反应:![]()
B.向![]() 溶液中加入过量氨水:
溶液中加入过量氨水:![]()
C.向![]() 溶液中加入过量
溶液中加入过量![]() 溶液:
溶液:![]()
D.向含![]() 和KOH均为0.1 mol的混合溶液中通人标准状况下4.48 L
和KOH均为0.1 mol的混合溶液中通人标准状况下4.48 L![]() 气体:
气体:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 异戊烷的一溴代物和1,2—二甲基环己烷的一溴代物都有4种(不考虑立体异构)
B. CH3CH=CHCH3分子中的所有原子在同一平面上
C. 按系统命名法,化合物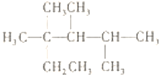 的名称是2,3,4-三甲基-2-乙基戊烷
的名称是2,3,4-三甲基-2-乙基戊烷
D. 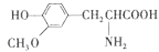 与
与![]() 二者互为同系物
二者互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按下图所示的装置进行实验。A、B为两种常见金属,它们的硫酸盐可溶于水,当K闭合时,Y极上产生黄绿色气体。下列分析正确的是( )

A. 溶液中c(SO42+)减小
B. B极的电极反应:B-2e-=B2+
C. Y电极上有Cl2产生,发生还原反应
D. 反应初期,X电极周围出现白色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com