
【题目】能充分说明可逆反应N2(g)+O2(g)![]() 2NO(g)已达到平衡状态的是( )
2NO(g)已达到平衡状态的是( )
A. 容器内压强不随时间改变
B. 容器内反应物总物质的量不随时间改变
C. 容器内气体N2、O2、NO的分子数之比为1:1:2
D. 单位时间内每消耗n mo1N2,同时生成2n mo1NO
科目:高中化学 来源: 题型:
【题目】十九大报告中提出“打赢蓝天保卫战”,对污染防治要求更高。某种利用垃圾渗透液实现发电、环保二位一体结合的装置示意图如下。当该装置工作时,下列说法正确的是
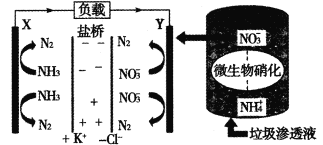
A.盐桥中Cl-向Y极移动
B.电路中流过7.5 mol电子时,共产生N2的体积为44.8 L(标况)
C.电流由X极沿导线流向Y极
D.Y极发生的反应为2NO3-+10e-+6H2O=N2↑+12OH-,周围pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,调节反应物用量或浓度不会改变反应产物的是( )
A.Fe与Cl2反应
B.CO2通入石灰水
C.HNO3中加入Cu
D.AlCl3溶液中滴入NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是( )
A.硅的原子结构示意图:
B.中子数为10的氧原子:![]() O
O
C.漂白粉有效成分的化学式;CaClO
D.NaHCO3在水溶液中的电离方程式:NaHCO3=Na++H++CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】格氏试剂(RMgX,X=Cl、Br、I)是一种重要的有机合成中间体,酯类化合物与格氏试剂的反应是合成叔醇类化合物的重要方法,由只含一种官能团的物质A制备E的合成路线如图,回答下列问题:

已知信息如下:
①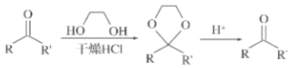
②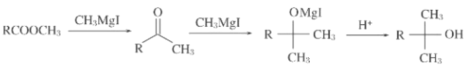
(1)A→B的反应类型为___,E的分子式为___。
(2)B中所含官能团的名称为___。
(3)C→D的化学方程式为___。
(4)M是比C多一个碳的C的同系物,同时满足下列条件的M的同分异构体有___种(不考虑立体异构)。
①含六元碳环结构,不含甲基;②能与NaHCO3溶液反应放出CO2;③能发生银镜反应。
写出其中核磁共振氢谱有七组峰,且峰面积的比是4∶4∶2∶1∶1∶1∶1的所有物质的结构简式___。
(5)将下列D→E的流程图补充完整:___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2(g)![]() 2NO(g)+ O2(g) 在体积不变的密闭容器中进行,达到平衡状态的标志是( )
2NO(g)+ O2(g) 在体积不变的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
A. ①④ B. ②③⑤ C. ①③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:回答下列问题:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:回答下列问题:
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=___。
(2)该反应为___反应(选填吸热、放热)。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为___℃。此温度下加入2molCO2(g)和2molH2(g),充分反应,达到平衡时,H2的转化率为___。
(4)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为:CO2(g)为2 mol/L,H2(g)为2mol/L,CO(g)为1mol/L,H2O(g)为3mol/L,则正、逆反应速率的关系为v(正)___v(逆)(填<、>、或=)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) H1=-890.3kJ·mol-1
CO(g)+![]() O2(g)=CO(g) H2=-283.0kJ·mol-1
O2(g)=CO(g) H2=-283.0kJ·mol-1
H2(g)+![]() O2(g)=H2O(l) H3=-285.8kJmol-1
O2(g)=H2O(l) H3=-285.8kJmol-1
CO(g)+H2O(g)=CO2(g)+H2(g) H4=-41.0kJmol-1
则甲烷水蒸气重整反应的△H=__kJ·mol-1。
(2)通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2的物质的量分数与水碳比、平衡温度的关系如图所示。
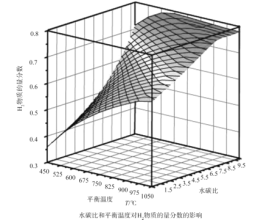
①H2的物质的量分数与水碳比(1~10)的关系是平衡温度一定时,__;其原因是__。
②据模拟实验可知,平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,CH4的转化率为__,其压强平衡常数为__;反应速率方程为v=kp(CH4)p-1(H2),此时反应速率=__(已知:气体分压=气体的物质的量分数×总压,速率方程中k为速率常数)。
(3)厌氧细菌可将葡萄糖转化为CH4和H2,pH为5.5时不同热预处理温度和时间下的甲烷和氢气的产率如图所示,若要提高H2的产率,最佳温度为__;与甲烷水蒸气重整制氢相比其优点有__(至少写两点)。
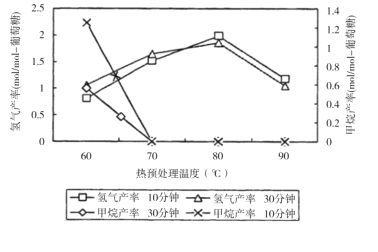
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com