
【题目】用NA表示阿伏加德罗常数的值。下列判断正确的是( )
A.1mol N2含有的原子数目为NA
B.24gMg变为Mg2+时失去的电子数目为2NA
C.1 molL﹣1CaCl2溶液中含有的Cl﹣数目为2NA
D.常温常压下,11.2LCO2中含有的原子数目为1.5NA
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列反应中,调节反应物用量或浓度不会改变反应产物的是( )
A.Fe与Cl2反应
B.CO2通入石灰水
C.HNO3中加入Cu
D.AlCl3溶液中滴入NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:回答下列问题:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:回答下列问题:
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=___。
(2)该反应为___反应(选填吸热、放热)。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为___℃。此温度下加入2molCO2(g)和2molH2(g),充分反应,达到平衡时,H2的转化率为___。
(4)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为:CO2(g)为2 mol/L,H2(g)为2mol/L,CO(g)为1mol/L,H2O(g)为3mol/L,则正、逆反应速率的关系为v(正)___v(逆)(填<、>、或=)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种无色溶液,可能含有以下离子中的若干种:Na+、NH4+、Cl﹣、Ba2+、HCO3﹣、SO42﹣,现取两份100mL的该溶液进行如下实验:
(1)第1份加足量NaOH溶液并加热,收集到标准状况下的气体672mL
(2)第2份加足量Ba(OH)2溶液,得沉淀6.27g,再用足量盐酸洗涤、干燥,得沉淀2.33g
根据上述实验,下列推测正确的是( )
A.该溶液中一定有Ba2+
B.c(NH4+)为0.3molL﹣1
C.100mL该溶液中含0.01 mol HCO3﹣
D.原溶液中c(Na+)和c(SO42﹣)的比值大于等于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,均含有相同的某种元素,在一定条件下,它们之间具有如下转化关系:甲![]() 乙
乙![]() 丙
丙![]() 丁。下列有关物质的推断不正确的是( )
丁。下列有关物质的推断不正确的是( )
A.若甲为C,则乙可能是CO
B.若甲为S,则丁可能是H2SO4
C.若甲为Na,则丙可能是Na2O2
D.若甲为Fe,则丁可能是Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法中正确的是( )
A. 等质量的硫蒸气和硫磺分别完全燃烧,后者放出的热量多
B. 氢气的燃烧热为285.8kJ ·![]() ,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l);△H=-285.8 kJ·
,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l);△H=-285.8 kJ·![]()
C. Ba(OH)2· 8H2O(s)+2NH4Cl(s)=BaCl2(s)+2NH3(g)+10H2O(l);△H<0
D. 某酸溶液可以与石灰石反应放出CO2,则该酸不一定为强酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) H1=-890.3kJ·mol-1
CO(g)+![]() O2(g)=CO(g) H2=-283.0kJ·mol-1
O2(g)=CO(g) H2=-283.0kJ·mol-1
H2(g)+![]() O2(g)=H2O(l) H3=-285.8kJmol-1
O2(g)=H2O(l) H3=-285.8kJmol-1
CO(g)+H2O(g)=CO2(g)+H2(g) H4=-41.0kJmol-1
则甲烷水蒸气重整反应的△H=__kJ·mol-1。
(2)通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2的物质的量分数与水碳比、平衡温度的关系如图所示。
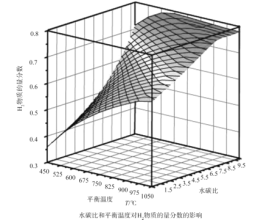
①H2的物质的量分数与水碳比(1~10)的关系是平衡温度一定时,__;其原因是__。
②据模拟实验可知,平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,CH4的转化率为__,其压强平衡常数为__;反应速率方程为v=kp(CH4)p-1(H2),此时反应速率=__(已知:气体分压=气体的物质的量分数×总压,速率方程中k为速率常数)。
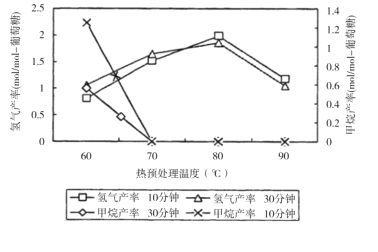
(3)厌氧细菌可将葡萄糖转化为CH4和H2,pH为5.5时不同热预处理温度和时间下的甲烷和氢气的产率如图所示,若要提高H2的产率,最佳温度为__;与甲烷水蒸气重整制氢相比其优点有__(至少写两点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.常温下,将![]() 的醋酸溶液稀释到原体积的10倍后,溶液的
的醋酸溶液稀释到原体积的10倍后,溶液的![]()
B.常温下,若NaHA溶液的![]() ,则
,则![]() 是弱酸
是弱酸
C.用盐酸标准溶液滴定氨水至中性时,![]() 未被完全中和
未被完全中和
D.![]() 时
时![]() 溶液的
溶液的![]() 大于
大于![]() 时NaCl溶液的
时NaCl溶液的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)现有以下物质:①NaCl晶体 ②液态HCl ③CaCO3固体 ④熔融KCl ⑤蔗糖 ⑥铜 ⑦CO2 ⑧H2SO4 ⑨KOH固体
a. 以上物质中能导电的是________________________________。
b. 以上物质中属于电解质的是_______________________,属于非电解质的是_______________________。
c. 以上物质中,溶于水且能导电的物质是_______________________。
(2)胶体和溶液的本质区别是________________,鉴别胶体和溶液所采用的方法是观察是否能发生___________效应。
(3)下列3个反应,按要求填写相关量。
①2Na2O2+2H2O=4NaOH+ O2↑反应中,每消耗1 mol Na2O2生成_____ g O2。
②在NaHCO3的热分解反应中,每消耗168 g NaHCO3,标准状况下生成_____L CO2。
③Cl2+H2O=HCl+HClO反应中,标准状况下每消耗22.4LCl2,转移_____mol电子。
(4)在一个密闭容器中放入以下四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下:
物质 | M | N | Q | P |
反应前质量(g) | 50 | 1 | 3 | 12 |
反应后质量(g) | x | 26 | 3 | 30 |
①该变化的基本反应类型是_____反应;
②物质Q在反应中起的作用是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com