
【题目】按要求回答下列问题:
(1)现有以下物质:①NaCl晶体 ②液态HCl ③CaCO3固体 ④熔融KCl ⑤蔗糖 ⑥铜 ⑦CO2 ⑧H2SO4 ⑨KOH固体
a. 以上物质中能导电的是________________________________。
b. 以上物质中属于电解质的是_______________________,属于非电解质的是_______________________。
c. 以上物质中,溶于水且能导电的物质是_______________________。
(2)胶体和溶液的本质区别是________________,鉴别胶体和溶液所采用的方法是观察是否能发生___________效应。
(3)下列3个反应,按要求填写相关量。
①2Na2O2+2H2O=4NaOH+ O2↑反应中,每消耗1 mol Na2O2生成_____ g O2。
②在NaHCO3的热分解反应中,每消耗168 g NaHCO3,标准状况下生成_____L CO2。
③Cl2+H2O=HCl+HClO反应中,标准状况下每消耗22.4LCl2,转移_____mol电子。
(4)在一个密闭容器中放入以下四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下:
物质 | M | N | Q | P |
反应前质量(g) | 50 | 1 | 3 | 12 |
反应后质量(g) | x | 26 | 3 | 30 |
①该变化的基本反应类型是_____反应;
②物质Q在反应中起的作用是_____。
【答案】④⑥ ①②③④⑧⑨ ⑤⑦ ①②④⑦⑧⑨ 分散质粒径大小不同 丁达尔 16 22.4 1 分解 催化剂
【解析】
(1)a. 含有自由移动的电子或阴阳离子的物质就能导电;
b. 在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里和熔融状态下都不导电的化合物是非电解质;
c. 以上物质中,溶于水且能导电的物质,说明水溶液中能发生电离,电离出自由移动的离子;
(2)分散系的分类标准是分散质颗粒直径大小不同,胶体有丁达尔效应,而溶液没有;
(3)①消耗1mol过氧化钠可以生成0.5mol氧气,然后根据m=nM计算出生成氧气的质量;
②根据n=![]() 计算出碳酸氢钠的物质的量,再根据方程式及V=nVm计算出生成标况下二氧化碳的体积;
计算出碳酸氢钠的物质的量,再根据方程式及V=nVm计算出生成标况下二氧化碳的体积;
③氯气与水的反应中,消耗1mol氯气转移了1mol电子;
(4)该反应中Q的质量不变,则Q为催化剂;根据质量守恒定律计算出X,然后根据质量变化判断反应物、生成物,从而得出该反应的反应类型。
(1)a. ④熔融KCl中含有自由移动离子、⑥铜含有自由移动的电子,所以④⑥都能导电;
b. ①NaCl晶体、②液态HCl、③CaCO3固体、④熔融KCl、⑧H2SO4、⑨KOH固体是电解质;⑤蔗糖、⑦CO2是非电解质;
c. 水溶液中能发生电离,电离出自由移动的离子或金属中存在自由移动的电子都可以导电,①NaCl晶体、②液态HCl、④熔融KCl、⑦CO2、⑧H2SO4、⑨KOH固体,溶于水溶液都能导电;⑥铜存在自由移动电子能导电;
(2)分散系的分类标准是分散质颗粒直径大小不同,则胶体和溶液的本质区别是散质粒径大小不同;胶体有丁达尔效应,而溶液没有,则鉴别胶体和溶液所采用的方法是观察是否能发生丁达尔效应;
(3)①2Na2O2+2H2O═4NaOH+O2↑反应中,每消耗1mol Na2O2生成会生成0.5mol氧气,生成氧气的质量为:32g/mol×0.5mol=16g;
②2NaHCO3═Na2CO3+H2O+CO2↑反应中,168gNaHCO3的物质的量为:![]() =2mol,根据反应可知,消耗2mol碳酸氢钠会生成1mol二氧化碳,标况下1mol二氧化碳的体积为:22.4L/mol×1mol=22.4L;
=2mol,根据反应可知,消耗2mol碳酸氢钠会生成1mol二氧化碳,标况下1mol二氧化碳的体积为:22.4L/mol×1mol=22.4L;
③Cl2+H2O═HCl+HClO反应中,氯气既是氧化剂也是还原剂,标况下22.4L Cl2的物质的量为:![]() =1mol,消耗1mol氯气转移了1mol电子;
=1mol,消耗1mol氯气转移了1mol电子;
(4)①根据质量守恒可知:X+26+3+30=50+1+3+12,解得:X=7,反应中M的质量减小,Q、P的质量增加,则该反应为M分解生成Q和P的反应,属于分解反应;
②根据表中数据可知,Q在反应前后的质量不变,则Q在反应中作催化剂。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列判断正确的是( )
A.1mol N2含有的原子数目为NA
B.24gMg变为Mg2+时失去的电子数目为2NA
C.1 molL﹣1CaCl2溶液中含有的Cl﹣数目为2NA
D.常温常压下,11.2LCO2中含有的原子数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 异戊烷的一溴代物和1,2—二甲基环己烷的一溴代物都有4种(不考虑立体异构)
B. CH3CH=CHCH3分子中的所有原子在同一平面上
C. 按系统命名法,化合物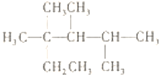 的名称是2,3,4-三甲基-2-乙基戊烷
的名称是2,3,4-三甲基-2-乙基戊烷
D. 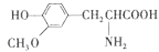 与
与![]() 二者互为同系物
二者互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓H2SO4(密度为1.84 g/mL)配制1 mol·L-1的稀H2SO4100mL,配制过程中可能用到下列仪器:
①100mL量筒;②10mL量筒;③50mL烧杯;④托盘天平;⑤100mL容量瓶;⑥胶头滴管;⑦玻璃棒。按使用出现的先后顺序排列正确的是
A. ②⑥③⑦⑤ B. ④③⑤⑦⑥ C. ①③⑦⑤⑥ D. ②⑤⑦⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇和稀硫酸。工业上用制作印刷电路的废液(含![]() 、
、![]() 、
、![]() 、
、![]() )生产CuCl的流程如图所示:
)生产CuCl的流程如图所示:

根据以上信息回答下列问题:
(1)生产过程中:X是______。(填化学式)
(2)写出生成CuCl的离子方程式______。
(3)析出的CuCl晶体不用水而用无水乙醇洗涤的原因是____。
(4)在CuCl的生成过程中理论上不需要补充SO2气体,其理由是___________。
(5)CuCl的另一种制备原理是Cu2++Cu+2Cl-=2CuCl K=5.85×106,向0.01 molL-1的CuCl2溶液中加入足量的铜,能否生成CuCl?(通过计算说明)_________。
(6)使用CuCl捕捉CO气体的反应为CuCl(s)+xCO(g) ![]() CuClxCO(s) △H < 0,为提高CO的平衡转化率,可采取的措施有____(填标号)。
CuClxCO(s) △H < 0,为提高CO的平衡转化率,可采取的措施有____(填标号)。
A 降低温度 B 增大压强 C 延长反应时间 D 把CuCl分散到疏松多孔的分子筛中
(7)已知:CuCl![]() Cu++Cl- K1; CuCl+Cl-
Cu++Cl- K1; CuCl+Cl-![]() CuCl2- K2;则反应Cu++2Cl-
CuCl2- K2;则反应Cu++2Cl-![]() CuCl2-的平衡常数K=_______(用K1、K2表示)。
CuCl2-的平衡常数K=_______(用K1、K2表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的实验装置进行电化学实验,下列判断正确的是( )
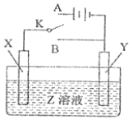
A. 若X为铝片,Y为镁片,Z为NaOH,将开关K置于B处则Y为原电池的负极
B. 若X为粗铜片,Y为精铜,Z为CuSO4,将开关K置于A处,一段时间后CuSO4溶液的浓度减小
C. 若X为铁片,Y为锌片,Z为NaCl,将开关K置于A或B处均可减缓铁的腐蚀
D. 若X、Y均为碳棒,Z为H2SO4,将开关K置于A处,一段时间后H2SO4的浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按下图所示的装置进行实验。A、B为两种常见金属,它们的硫酸盐可溶于水,当K闭合时,Y极上产生黄绿色气体。下列分析正确的是( )

A. 溶液中c(SO42+)减小
B. B极的电极反应:B-2e-=B2+
C. Y电极上有Cl2产生,发生还原反应
D. 反应初期,X电极周围出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种高效净水剂。已知:K2FeO4易溶于水,微溶于浓KOH溶液;在酸性或中性溶液中不稳定,在0~5℃的强碱性溶液中较稳定。某实验小组欲制备高铁酸钾并测定其纯度。
Ⅰ.制备高铁酸钾(夹持装置略)
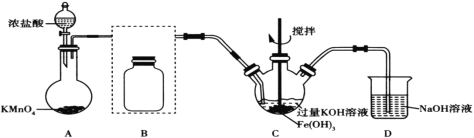
(1)装置A为氯气发生装置,其中盛放高锰酸钾的仪器名称为__。
(2)将除杂装置B补充完整并标明所用试剂__。
(3)装置C中Cl2与Fe(OH)3、KOH反应生成K2FeO4的化学方程式是____。
(4)实验时将装置C置于冰水浴中,其原因是____。
(5)实验后经结晶法得到的K2FeO4晶体仍含较多杂质,要得到更纯的晶体,还应采取的操作方法是____。
Ⅱ.测定产品纯度
(6)将wg K2FeO4粗产品溶于过量的碱性亚铬酸盐溶液中,充分反应后,加入稀硫酸酸化至pH为2,在所得的重铬酸盐溶液中加入5滴二苯胺磺酸钠溶液作指示剂,然后用c mol·L1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液VmL。已知该过程中涉及的离子反应主要有三个:
①Cr(OH)4+ FeO42-=Fe(OH)3↓+CrO42-+OH,
②_______,
③Cr2O72-+6Fe2++ 14H+=6Fe3+ +2Cr3+ +7H2O。
该粗产品中K2FeO4的质量分数为__(用含w、c、V的代数式表示)。若滴定管没有用标准液润洗,则测得的结果__(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学方程式为(HAc表示醋酸)Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac。
请回答下列问题:
(1)化合物Cu(NH3)3(CO)Ac中,铜元素的化合价为___。
(2)该反应中含有的第二周期非金属元素的第一电离能由大到小的顺序是___。
(3)写出基态Cu2+的电子排布式:___,向Cu2+的溶液中加入过量NaOH溶液,可生成Cu2+配位数为4的配位离子,写出该配位离子的结构式___。
(4)CO与N2互为等电子体,二者沸点较高的是___,理由是____。
(5)在一定条件下,NH3和CO2能合成尿素CO(NH2)2,尿素中碳原子和氮原子的杂化轨道类型分别是:___和___。
(6)Cu与O形成的某种化合物的晶胞结构如图所示。
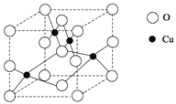
①在一个晶胞中,氧原子的数目为___。
②该化合物的化学式为____。
③晶胞的边长为apm,则该晶胞的密度为_____gcm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com