
【题目】用如图所示的实验装置进行电化学实验,下列判断正确的是( )
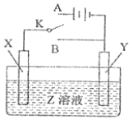
A. 若X为铝片,Y为镁片,Z为NaOH,将开关K置于B处则Y为原电池的负极
B. 若X为粗铜片,Y为精铜,Z为CuSO4,将开关K置于A处,一段时间后CuSO4溶液的浓度减小
C. 若X为铁片,Y为锌片,Z为NaCl,将开关K置于A或B处均可减缓铁的腐蚀
D. 若X、Y均为碳棒,Z为H2SO4,将开关K置于A处,一段时间后H2SO4的浓度不变
【答案】B
【解析】
A.若X为铝片,Y为镁片,Z为NaOH,将开关K置于B处形成原电池,Al与NaOH反应而Mg不反应,则X为原电池的负极,A错误;
B. 若X为粗铜片,Y为精铜,Z为CuSO4,将开关K置于A处,形成电解池,粗铜作阳极,粗铜中的比铜活泼的杂质也会溶解,如锌失电子生成锌离子,阴极上只有溶液中的铜离子得电子生成单质铜,故一段时间后CuSO4溶液的浓度减小,B正确;
C. 若X为铁片,Y为锌片,Z为NaCl,将开关K置于A 处时,形成电解池,Fe作阳极,失电子生成Fe2+,加快了铁的腐蚀,C错误;
D. 若X、Y均为碳棒,Z为H2SO4,将开关K置于A处,形成电解池,电解水,一段时间后,水的物质的量减少,溶液的体积减小,H2SO4的浓度增大,D错误;
答案为B。


科目:高中化学 来源: 题型:
【题目】下列说法或表示方法中正确的是( )
A. 等质量的硫蒸气和硫磺分别完全燃烧,后者放出的热量多
B. 氢气的燃烧热为285.8kJ ·![]() ,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l);△H=-285.8 kJ·
,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l);△H=-285.8 kJ·![]()
C. Ba(OH)2· 8H2O(s)+2NH4Cl(s)=BaCl2(s)+2NH3(g)+10H2O(l);△H<0
D. 某酸溶液可以与石灰石反应放出CO2,则该酸不一定为强酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积可变的恒温密闭容器中按![]() 充入
充入![]() 和
和![]() ,发生反应:
,发生反应:![]()
![]() ,在t1时刻达到平衡状态I;在t2时刻向容器中充入一定量的
,在t1时刻达到平衡状态I;在t2时刻向容器中充入一定量的![]() ,t3时刻达到平衡状态Ⅱ。下列说法正确的是
,t3时刻达到平衡状态Ⅱ。下列说法正确的是
A.t1时刻达到平衡时,v(N2)=3v(H2)
B.t1时刻达到平衡时反应放出的热量小于Q kJ
C.达到平衡时,![]() 的体积分数:
的体积分数:![]()
D.![]() 过程中,v(逆)随时间变化如图所示
过程中,v(逆)随时间变化如图所示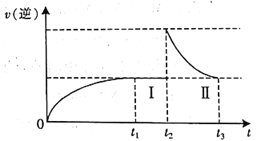
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究二元化合物X的组成和性质,某研究小组设计并完成了如下实验(步骤中所加试剂均过量,部分产物已略去)。
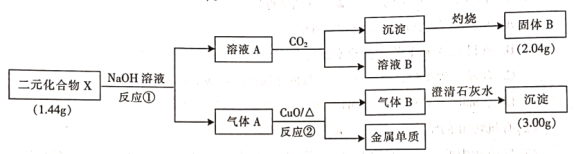
请回答下列问题:
(1)写出X中含有的元素________(用元素符号表示)。
(2)写出反应①的离子方程式___________。
(3)写出反应②的化学方程式___________。
(4)设计实验检验溶液B中所含溶质的阴离子:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)现有以下物质:①NaCl晶体 ②液态HCl ③CaCO3固体 ④熔融KCl ⑤蔗糖 ⑥铜 ⑦CO2 ⑧H2SO4 ⑨KOH固体
a. 以上物质中能导电的是________________________________。
b. 以上物质中属于电解质的是_______________________,属于非电解质的是_______________________。
c. 以上物质中,溶于水且能导电的物质是_______________________。
(2)胶体和溶液的本质区别是________________,鉴别胶体和溶液所采用的方法是观察是否能发生___________效应。
(3)下列3个反应,按要求填写相关量。
①2Na2O2+2H2O=4NaOH+ O2↑反应中,每消耗1 mol Na2O2生成_____ g O2。
②在NaHCO3的热分解反应中,每消耗168 g NaHCO3,标准状况下生成_____L CO2。
③Cl2+H2O=HCl+HClO反应中,标准状况下每消耗22.4LCl2,转移_____mol电子。
(4)在一个密闭容器中放入以下四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下:
物质 | M | N | Q | P |
反应前质量(g) | 50 | 1 | 3 | 12 |
反应后质量(g) | x | 26 | 3 | 30 |
①该变化的基本反应类型是_____反应;
②物质Q在反应中起的作用是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种化合物 ,均含有某种常见金属元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为紫色(透过蓝色钴玻璃观察)。

请回答下列问题:
(1)写出化学式:B____________,D___________。
(2)五种化合物中难溶于水的是___________________(填化学式)。
(3)写出下列反应的离子方程式:
A→B:_________________________________________________。
B→E:_________________________________________________。
C→E:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学设计了如图所示的装置,完成下列问题:
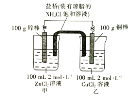
(1)反应过程中,______棒质量增加。
(2)总反应的离子方程式为_____。
(3)反应中,当其中一个电极质量变为102g时,另一电极质量______________(填大于、小于或等于)98g。
(4)反应过程中,盐桥中的________ 离子进入甲杯。
(5)当外电路中转移0.2mol电子时,乙烧杯中浓度最大的阳离子是_________,其物质的量浓度为_______________。(假设溶液体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种常见的一种金属,F是一种红褐色的沉淀。试根据图中转化关系,回答下列问题。
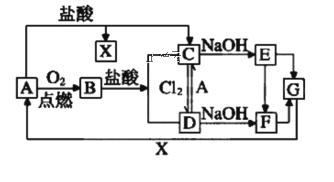
(1)写出A、B、D、E的化学式:A___、B___、D___、E___。
(2)检验D中阳离子的方法:___。
(3)保存C溶液时为什么加固体A___。
(4)写出下列转化的离子方程式
①C→E___。
②A→C___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含砷氧化铜矿[含CuO、Cu2(OH)2CO3、As2O3及重金属盐等]制取Cu2(OH)2SO4的工艺流程如下:
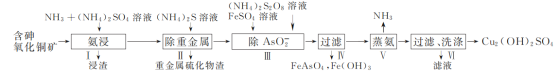
(1) 步骤Ⅰ“氨浸”时,控制温度为50~55 ℃,pH约为9.5,含铜化合物转化为[Cu(NH3)4]SO4溶液。
① CuO被浸取的离子方程式为________。
②浸取温度不宜超过55 ℃,其原因是________。
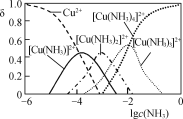
③ Cu2+与NH3结合时,溶液中含铜微粒的物质的量分布分数(δ)与溶液中游离的c(NH3)的对数值的关系如图所示。若用1 L浸取液(由等物质的量NH3和NH4+组成)将amolCu2(OH)2CO3全部浸出为[Cu(NH3)4]2+(CO32-转变为HCO3-,不考虑其他反应,溶液体积变化忽略不计),原浸取液中起始时c(NH3)应满足的条件是________。
(2) “除AsO2-”时,FeSO4需过量,一方面使AsO2-沉淀完全,另一目的是________。
(3) “蒸氨”时发生反应的化学方程式为________。
(4) 为了实现生产过程中物质循环利用,可采取的措施为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com