
【题目】用蒸馏水稀释0. 1mol/L的CH3COOH溶液时,始终保持增大趋势的是
A. c(CH3COOH)B. c(H+)C. c(CH3COO-)D. c(OH-)
【答案】D
【解析】
A.CH3COOH是弱电解质,在水中发生部分电离,CH3COOH![]() H++CH3COO-,加蒸馏水稀释可促进其电离,则c(CH3COOH)减小,故A错误;
H++CH3COO-,加蒸馏水稀释可促进其电离,则c(CH3COOH)减小,故A错误;
B.CH3COOH是弱电解质,在水中发生部分电离,CH3COOH![]() H++CH3COO-,加蒸馏水稀释可促进其电离,则n(H+)增大,但是H+物质的量的增大程度远小于溶液体积的增大程度,所以c(H+)减小,故B错误;
H++CH3COO-,加蒸馏水稀释可促进其电离,则n(H+)增大,但是H+物质的量的增大程度远小于溶液体积的增大程度,所以c(H+)减小,故B错误;
C.CH3COOH是弱电解质,在水中发生部分电离,CH3COOH![]() H++CH3COO-,加蒸馏水稀释可促进其电离,则n c(CH3COO-)增大,但是CH3COO-物质的量的增大程度远小于溶液体积的增大程度,所以c(CH3COO-)减小,故C错误;
H++CH3COO-,加蒸馏水稀释可促进其电离,则n c(CH3COO-)增大,但是CH3COO-物质的量的增大程度远小于溶液体积的增大程度,所以c(CH3COO-)减小,故C错误;
D.由B可知,c(H+)减小,由于Kw=c(H+)c(OH-)为定值,所以c(OH-)保持增大趋势,故D正确。
故选D。


科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是( )
A.硅的原子结构示意图:
B.中子数为10的氧原子:![]() O
O
C.漂白粉有效成分的化学式;CaClO
D.NaHCO3在水溶液中的电离方程式:NaHCO3=Na++H++CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200 ℃时,天然气脱硫工艺中会发生下列反应:H2S(g)+![]() O2(g)===SO2(g)+H2O(g) ΔH1,2H2S(g)+SO2(g)===
O2(g)===SO2(g)+H2O(g) ΔH1,2H2S(g)+SO2(g)===![]() S2(g)+2H2O(g) ΔH2,H2S(g)+1/2O2(g)===S(g)+H2O(g) ΔH3,2S(g)===S2(g) ΔH4 则ΔH4的正确表达式为( )
S2(g)+2H2O(g) ΔH2,H2S(g)+1/2O2(g)===S(g)+H2O(g) ΔH3,2S(g)===S2(g) ΔH4 则ΔH4的正确表达式为( )
A. ΔH4=![]() (ΔH1+ΔH2-3ΔH3)B. ΔH4=
(ΔH1+ΔH2-3ΔH3)B. ΔH4=![]() (3ΔH3-ΔH1-ΔH2)
(3ΔH3-ΔH1-ΔH2)
C. ΔH4=![]() (ΔH1+ΔH2-3ΔH3)D. ΔH4=
(ΔH1+ΔH2-3ΔH3)D. ΔH4=![]() (ΔH1-ΔH2-3ΔH3)
(ΔH1-ΔH2-3ΔH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,均含有相同的某种元素,在一定条件下,它们之间具有如下转化关系:甲![]() 乙
乙![]() 丙
丙![]() 丁。下列有关物质的推断不正确的是( )
丁。下列有关物质的推断不正确的是( )
A.若甲为C,则乙可能是CO
B.若甲为S,则丁可能是H2SO4
C.若甲为Na,则丙可能是Na2O2
D.若甲为Fe,则丁可能是Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如图装置进行中和热的测定。回答下列问题:
(1)该图中有一处未画出,它是_______填仪器名称)。
(2)在操作正确的前提下提高中和热测定的准确性的关键是____。
(3)如果用0.50 mol/L的盐酸和氢氧化钠固体进行实验,则根据此实验的数据书写中和热的热化学方程式中的H将____(填“偏大”“偏小”或“不变”),原因是_______。
(4)利用50 mL 0.50 mol/L的稀盐酸与50 mL 0.55 mol/L的稀氢氧化钠溶液进行实验,设溶液的密度均为1 g/cm3,中和后溶液的比热容c=4.18 J/(g·℃),请根据实验数据计算中和热H= __ (取小数点后一位)。
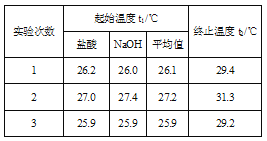
(5)上述(4)中的结果与中和热的理论值有偏差,产生偏差的原因可能是___。
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) H1=-890.3kJ·mol-1
CO(g)+![]() O2(g)=CO(g) H2=-283.0kJ·mol-1
O2(g)=CO(g) H2=-283.0kJ·mol-1
H2(g)+![]() O2(g)=H2O(l) H3=-285.8kJmol-1
O2(g)=H2O(l) H3=-285.8kJmol-1
CO(g)+H2O(g)=CO2(g)+H2(g) H4=-41.0kJmol-1
则甲烷水蒸气重整反应的△H=__kJ·mol-1。
(2)通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2的物质的量分数与水碳比、平衡温度的关系如图所示。
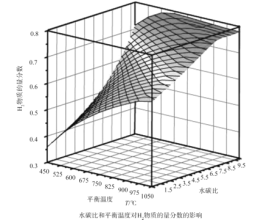
①H2的物质的量分数与水碳比(1~10)的关系是平衡温度一定时,__;其原因是__。
②据模拟实验可知,平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,CH4的转化率为__,其压强平衡常数为__;反应速率方程为v=kp(CH4)p-1(H2),此时反应速率=__(已知:气体分压=气体的物质的量分数×总压,速率方程中k为速率常数)。
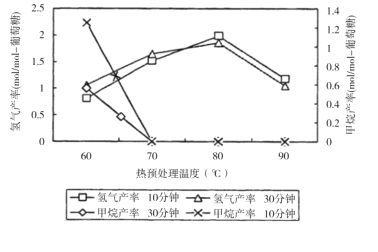
(3)厌氧细菌可将葡萄糖转化为CH4和H2,pH为5.5时不同热预处理温度和时间下的甲烷和氢气的产率如图所示,若要提高H2的产率,最佳温度为__;与甲烷水蒸气重整制氢相比其优点有__(至少写两点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应的反应速率最快的是
3C(g)+4D(g)反应中,表示该反应的反应速率最快的是
A.v(A)=0.5 mol·L1·min 1B.v(B)=0.1 mol·L1·s1
C.v(C)=0.8 mol·L1·min 1D.v(D)=1 mol·L1·min 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
②CH3OH(g)+![]() O2(g)===CO2(g)+2H2O(g) ΔH=-192.9 kJ/mol
O2(g)===CO2(g)+2H2O(g) ΔH=-192.9 kJ/mol
由上述方程式可知:CH3OH的燃烧热________(填“大于”“等于”或“小于”)192.9 kJ/mol。
已知水的气化热为44 kJ/mol。则表示氢气燃烧热的热化学方程式为__________。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。
已知:①2NH3(g)+CO2(g)===NH2CO2NH4(s) ΔH=-159.5 kJ/mol
②NH2CO2NH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+116.5 kJ/mol
③H2O(l)===H2O(g) ΔH=+44.0 kJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式是_____________________________。
(3)已知:①Fe(s)+![]() O2(g)===FeO(s) ΔH1=-272.0 kJ/mol
O2(g)===FeO(s) ΔH1=-272.0 kJ/mol
②2Al(s)+![]() O2(g)===Al2O3(s) ΔH2=-1675.7 kJ/mol
O2(g)===Al2O3(s) ΔH2=-1675.7 kJ/mol
Al和FeO发生铝热反应的热化学方程式是_____________________________________。该反应的自发性趋势很大,原因是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、V、W五种短周期元素,原子序数依次增大,其中Z的原子半径最大,Z的单质在W的单质中燃烧产生黄色火焰;五种元素可以组成一种有机盐(如图所示)。下列说法正确的是( )
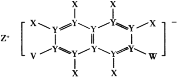
A.Y与W形成的分子中各原子最外层均满足8电子稳定结构
B.原子半径的大小关系为:V >Z > W
C.热稳定性:X与V组成的二元化合物>X与W组成的二元化合物
D.Y与V组成的二元化合物分子中含有两个Y-V键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com