
����Ŀ����1����֪����CH3OH(g)��H2O(g)===CO2(g)��3H2(g)����H����49.0 kJ/mol
��CH3OH(g)��![]() O2(g)===CO2(g)��2H2O(g)����H����192.9 kJ/mol
O2(g)===CO2(g)��2H2O(g)����H����192.9 kJ/mol
����������ʽ��֪��CH3OH��ȼ����________(����������������������С����)192.9 kJ/mol��
��֪ˮ��������Ϊ44 kJ/mol�����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽΪ__________��
��2����CO2��NH3Ϊԭ�Ͽɺϳɻ�������[��ѧʽΪCO(NH2)2]��
��֪����2NH3(g)��CO2(g)===NH2CO2NH4(s)����H����159.5 kJ/mol
��NH2CO2NH4(s)===CO(NH2)2(s)��H2O(g)����H����116.5 kJ/mol
��H2O(l)===H2O(g)����H����44.0 kJ/mol
д��CO2��NH3�ϳ����غ�Һ̬ˮ���Ȼ�ѧ����ʽ��_____________________________��
��3����֪����Fe(s)��![]() O2(g)===FeO(s)����H1����272.0 kJ/mol
O2(g)===FeO(s)����H1����272.0 kJ/mol
��2Al(s)��![]() O2(g)===Al2O3(s)����H2����1675.7 kJ/mol
O2(g)===Al2O3(s)����H2����1675.7 kJ/mol
Al��FeO�������ȷ�Ӧ���Ȼ�ѧ����ʽ��_____________________________________���÷�Ӧ���Է������ƺܴ�ԭ����________________________________________��
���𰸡����� H2(g)��![]() O2(g)===H2O(l) ��H1����124.6kJ��mol��1 2NH3(g)��CO2(g)===CO(NH2)2(s)��H2O(l)����H����87.0 kJ/mol 3FeO(s)��2Al(s)===Al2O3(s)��3Fe(s)����H����859.7 kJ/mol �÷�Ӧ�ų���������
O2(g)===H2O(l) ��H1����124.6kJ��mol��1 2NH3(g)��CO2(g)===CO(NH2)2(s)��H2O(l)����H����87.0 kJ/mol 3FeO(s)��2Al(s)===Al2O3(s)��3Fe(s)����H����859.7 kJ/mol �÷�Ӧ�ų���������
��������
��1���״���ȼ����Ϊ1mol�״���ȫȼ�������ȶ��������ˮӦΪҺ̬�ȶ������ݸ�˹������⣻
��2�����ݸ�˹������⣻
��3�����ݸ�˹������⣬��G=H-ST�жϡ�
��1���״���ȼ����Ϊ1mol�״���ȫȼ�������ȶ��������ˮӦΪҺ̬����̬ˮ��ΪҺ̬ˮʱ�ͷ���������ȼ���ȴ���192.9 kJ/mol����֪ˮ��������Ϊ44kJ/mol����H2O(g)=H2O(l) ��H��-44 kJ/mol�����ݸ�˹���ɣ�����-��+3�ۣ�/3�ɵ�H2(g)+![]() O2(g)== H2O(l)����H������192.9-49.0-44��3��/3=-124.6kJ/mol��
O2(g)== H2O(l)����H������192.9-49.0-44��3��/3=-124.6kJ/mol��
��2�����ݸ�˹���ɣ���+��-�ۿɵã�2NH3(g)��CO2(g)==CO(NH2)2(s)��H2O(l)����H����-159.5+116.5-44.0��kJ/mol=-87.0kJ/mol��
��3�����ݸ�˹���ɣ���-����3�ɵã�2Al(s)��3FeO(s)==Al2O3(s)+3Fe(s)����H����-1675.7+272.0��3��kJ/mol=��859.7kJ/mol��G=H-ST��G<0�����Է����У��÷�Ӧ���Է������ƺܴ�S�仯����˵��H<0���÷�Ӧ�ų��������ȡ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ��С��Ϊ̽��SO2��Cl2�����ʣ����Ƚ�SO2����ˮ��Ư���ԣ���������µ�ʵ�顣
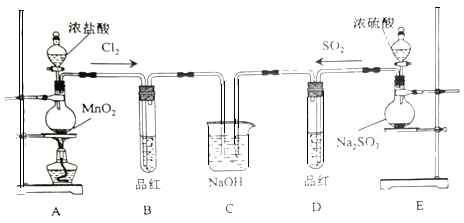
��1��ͼ��ʢ��Ũ��������������Ϊ___��װ��A�з�����Ӧ�Ļ�ѧ����ʽ___��
��2����Ӧһ��ʱ���B��D��Ʒ����ɫ����Ӧ�����ֱ����B��D�е��Թܣ��ɹ۲쵽������Ϊ��B___��D___��
��3��Cװ�õ�����������β����д��SO2������NaOH��Һ��Ӧ�����ӷ���ʽ��___��
��4����ͬѧ��SO2��Cl2��1��1ͬʱͨ�뵽Ʒ����Һ�У�������ɫЧ���������ԡ����ܵ�ԭ����___���û�ѧ����ʽ��ʾ�������ʵ��֤������ԭ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮϡ��0. 1mol/L��CH3COOH��Һʱ��ʼ�ձ����������Ƶ���
A. c(CH3COOH)B. c(H+)C. c(CH3COO��)D. c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з���ʽ��д��ȷ����
A.�����鷢����ȥ��Ӧ��![]()
B.��![]() ��Һ�м��������ˮ��
��Һ�м��������ˮ��![]()
C.��![]() ��Һ�м������
��Һ�м������![]() ��Һ��
��Һ��![]()
D.��![]() ��KOH��Ϊ0.1 mol�Ļ����Һ��ͨ�˱�״����4.48 L
��KOH��Ϊ0.1 mol�Ļ����Һ��ͨ�˱�״����4.48 L![]() ���壺
���壺![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.�����ܶ�С��ˮ������Ϊ����ˮ���ӵ�������·��Ӽ���ֽϴ��϶
B.�⾧���Ƿ��Ӿ��壬��������������ֻ��˷�ԭ�Ӽ�������
C.ij����������̬ʱ�ܵ��磬�������һ�������ӻ�����
D.��![]() ��
��![]() �����У��������������Ӹ����Ⱦ�Ϊ
�����У��������������Ӹ����Ⱦ�Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A. �������һ������1��2�������������һ����ﶼ��4�֣������������칹��
B. CH3CH=CHCH3�����е�����ԭ����ͬһƽ����
C. ��ϵͳ��������������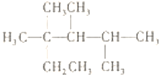 ��������2��3��4-����-2-�һ�����
��������2��3��4-����-2-�һ�����
D. 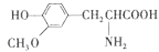 ��
��![]() ����Ϊͬϵ��
����Ϊͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ��![]() ��
��![]() ��
��![]() ��
��![]() ��������Һ����ʼʱ�������Ϊ
��������Һ����ʼʱ�������Ϊ![]() ���ֱ�������Һ�м�ˮ����ϡ�ͣ�ϡ�ͺ���Һ���ΪV������������ͼ��ʾ������˵����ȷ����
���ֱ�������Һ�м�ˮ����ϡ�ͣ�ϡ�ͺ���Һ���ΪV������������ͼ��ʾ������˵����ȷ����
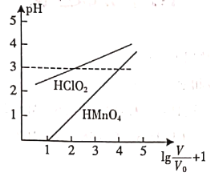
A.��![]() ʱ��
ʱ��![]() ��Һ����
��Һ����![]()
B.��ϡ����pH��Ϊ3ʱ����Һ��![]()
C.ϡ��ǰ�ֱ���![]() ��NaOH��Һ�кͣ����ĵ�NaOH��Һ�����
��NaOH��Һ�кͣ����ĵ�NaOH��Һ�����![]()
D.�����£�Ũ�Ⱦ�Ϊ![]() ��
��![]() ��
��![]() ��Һ��
��Һ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���ͭ��CuCl���������л��ϳɹ�ҵ�еĴ�������һ�ְ�ɫ��ĩ������ˮ���������Ҵ���ϡ���ᡣ��ҵ��������ӡˢ��·�ķ�Һ����![]() ��
��![]() ��
��![]() ��
��![]() ������CuCl��������ͼ��ʾ��
������CuCl��������ͼ��ʾ��

����������Ϣ�ش��������⣺
��1�����������У�X��______�����ѧʽ��
��2��д������CuCl�����ӷ���ʽ______��
��3��������CuCl���岻��ˮ������ˮ�Ҵ�ϴ�ӵ�ԭ����____��
��4����CuCl�����ɹ����������ϲ���Ҫ����SO2���壬��������___________��
��5��CuCl����һ���Ʊ�ԭ����Cu2++Cu+2Cl����2CuCl K��5.85��106����0.01 molL��1��CuCl2��Һ�м���������ͭ���ܷ�����CuCl����ͨ������˵����_________��
��6��ʹ��CuCl��CO����ķ�ӦΪCuCl(s)+xCO(g) ![]() CuClxCO(s) ��H < 0��Ϊ���CO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��____�����ţ���
CuClxCO(s) ��H < 0��Ϊ���CO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��____�����ţ���
A �����¶� B ����ѹǿ C �ӳ���Ӧʱ�� D ��CuCl��ɢ�����ɶ�ķ���ɸ��
��7����֪��CuCl![]() Cu++Cl�� K1�� CuCl+Cl-
Cu++Cl�� K1�� CuCl+Cl-![]() CuCl2�� K2����ӦCu++2Cl��
CuCl2�� K2����ӦCu++2Cl��![]() CuCl2����ƽ�ⳣ��K��_______����K1��K2��ʾ����
CuCl2����ƽ�ⳣ��K��_______����K1��K2��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ۺ����ü������ڽ�Լ��Դ���������ڱ���������ʵ�������÷Ͼɵ�ص�ͭñ��Cu��Zn�ܺ���ԼΪ99%������Cu���Ʊ�ZnO�IJ���ʵ�������ͼ��
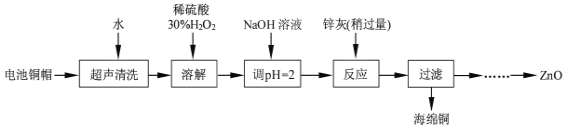
��1����д��ͭñ�ܽ�ʱͭ������ϡ���ᡢ30%H2O2��Ӧ�����ӷ�Ӧ����ʽ___��
��ͭñ�ܽ���ȫ���轫��Һ�й�����H2O2��ȥ����ȥH2O2�ļ�㷽����___��
��2��Ϊȷ������п��(��Ҫ�ɷ�ΪZn��ZnO������Ϊ������������)������ʵ������ⶨ��ȥH2O2����Һ��Cu2���ĺ�����
ʵ�����Ϊ��ȷ��ȡһ������ĺ���Cu2������Һ�ڴ�����ƿ�У�������ˮϡ�ͣ�������ҺpH=3��4�����������KI����Na2S2O3����Һ�ζ����յ㡣���������з�Ӧ�����ӷ���ʽ���£�2Cu2��+4I-=2CuI��(��ɫ)+I2��2S2O32-+I2=2I-+S4O62-
�ζ�ѡ�õ�ָʾ��Ϊ___���ﵽ�ζ��յ�۲쵽������Ϊ___��
��3�������£�����50mL0.0001mol/LCuSO4��Һ�м���50mL0.00022mol/LNaOH��Һ�������˳�������֪KSP[Cu(OH)2]=2.0��10-20(mol/L)3������������ɺ���Һ��c(Cu2+)=__mol/L��
��4����֪pH>11ʱZn(OH)2������NaOH��Һ����[Zn(OH)4]2-���±��г��˼������������������������pH(��ʼ������pH����������Ũ��Ϊ1.0mol��L-1����)��
��ʼ������pH | ������ȫ��pH | |
Fe3�� | 1.1 | 3.2 |
Fe2�� | 5.8 | 8.8 |
Zn2�� | 5.9 | 8.9 |
ʵ���п�ѡ�õ��Լ���30%H2O2��1.0mol��L-1HNO3��1.0mol��L-1NaOH���ɳ�ȥͭ����Һ�Ʊ�ZnO��ʵ�鲽������Ϊ��������Һ�м�������30%H2O2��ʹ���ַ�Ӧ��
��___���۹��ˣ���___���ݹ��ˡ�ϴ�ӡ������900�����ա�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com