
| A. | 题述反应条件下还原性:CO>Pd | |
| B. | 题述反应中PdCl2被氧化 | |
| C. | 在标况下生成11.2 L CO2时,转移的电子为2 mo1 | |
| D. | 题述反应中CO2为氧化产物 |
分析 CO+PdCl2+H2O=CO2+Pd↓+2HCl中,C元素的化合价由+2价升高为+4价,Pb元素的化合价由+2降低为0,结合元素化合价的变化解答该题.
解答 解:CO+PdCl2+H2O=CO2+Pd↓+2HCl中,C元素的化合价由+2价升高为+4价,Pb元素的化合价由+2降低为0,
A.反应中PdCl2为氧化剂,CO为还原剂,则还原性:CO>Pd,故A正确;
B.Pb元素的化合价由+2降低为0,反应中PbCl2被还原,故B错误;
C.在标况下生成11.2 L CO2时,即生成0.5molCO2,转移的电子为1 mo1,故C错误;
D.C元素的化合价由+2价升高为+4价,C元素的化合价升高被氧化,所以CO2为氧化产物,故D正确.
故选AD.
点评 本题考查氧化还原反应,侧重于学生的分析能力的考查,明确反应中元素的化合价变化及基本概念即可解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
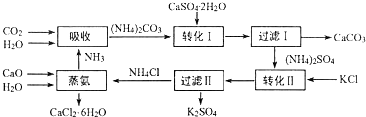
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
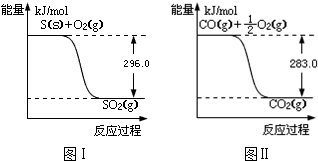
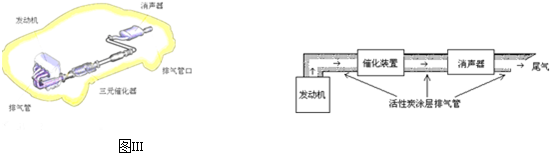
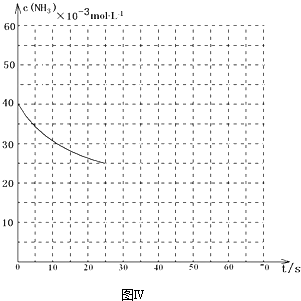
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是 ( )(多项选择题)
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是 ( )(多项选择题)| A. | 该物质能使鲜花长期盛开 | |
| B. | 1mol该物质与NaOH溶液反应,最多消耗1mol NaOH | |
| C. | 该物质既能发生加聚反应,又能发生缩聚反应 | |
| D. | 该物质既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 | |
| E. | 该物质分子式为C15H20O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
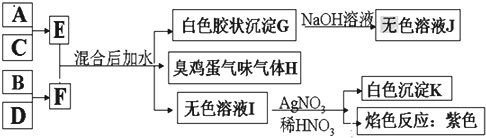
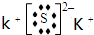 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
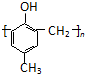 )的合成路线如下:
)的合成路线如下: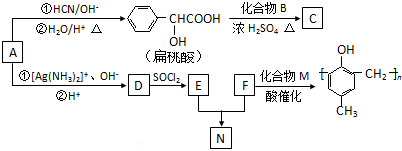
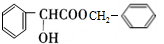 .
. .
.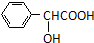 )有多种同分异构体.属于甲酸酯且含酚羟基的同分异构体有13种,写出其中一个含亚甲基(-CH2-)的同分异构体的结构简式
)有多种同分异构体.属于甲酸酯且含酚羟基的同分异构体有13种,写出其中一个含亚甲基(-CH2-)的同分异构体的结构简式 (任意一种).
(任意一种).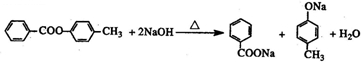 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | 加入试剂 | 有关化学方程式 |
| FeCl2(FeCl3)(溶液) | Fe | 2FeCl3+Fe=3FeCl2 |
| MgO(Al2O3) | NaOH溶液 | Al2O3+2NaOH═2NaAlO2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10%的盐酸蒸发浓缩获得30%的盐酸 | |
| B. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| C. | 二氧化硫具有漂白性,与氯水混合使用效果更好 | |
| D. | 可利用丁达尔效应来区别淀粉溶液和氯化钠溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com