
【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是![]() ,并含少量的
,并含少量的![]() 、
、![]() 、MgO、CaO等,生产工艺流程图如下:
、MgO、CaO等,生产工艺流程图如下:
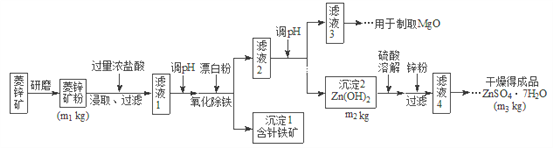
(1)将菱锌矿研磨成粉的目的是_______________。
(2)写出Fe3+水解的离子方程式_________________。
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为__________。
沉淀化学式 |
|
|
|
|
开始沉淀的pH |
|
|
|
|
沉淀完全的pH |
|
|
|
|
开始溶解的pH |
|
|
|
|
Ksp |
|
|
|
|
(4)工业上从“滤液3”制取MgO过程中,合适的反应物是________选填序号。
![]() 大理石粉
大理石粉 ![]() 石灰乳 c纯碱溶液 d氨水
石灰乳 c纯碱溶液 d氨水
(5)“滤液4”之后的操作依次为________、_______、过滤,洗涤,干燥。
(6)分析图中数据,菱锌矿粉中![]() 的质量分数不低于__________用代数式表示
的质量分数不低于__________用代数式表示
【答案】 增大反应物接触面积或增大反应速率或使反应更充分 Fe3++3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+ ![]() bd 蒸发浓缩 冷却结晶 125m2
bd 蒸发浓缩 冷却结晶 125m2![]() 1
1
【解析】考查化学工艺流程,(1)将棱锌矿研磨成粉的目的是增大反应物接触面积或增大反应速率或使反应更充分;(2)Fe3+为弱碱根离子,水解的离子方程式为Fe3++3H2O![]() Fe(OH)3+3H+;(3)滤液2中调节pH,得到滤液3和Zn(OH)2,即Mg2+不能出现沉淀,Zn(OH)2不溶解,因此pH的区间为
Fe(OH)3+3H+;(3)滤液2中调节pH,得到滤液3和Zn(OH)2,即Mg2+不能出现沉淀,Zn(OH)2不溶解,因此pH的区间为![]() ;(4)a、大理石不溶于水,无法让Mg2+转化成Mg(OH)2,故a错误;b、加入石灰乳,利用氢氧化镁比Ca(OH)2更难溶的性质,将Mg2+转化成Mg(OH)2,故b正确;c、纯碱与Mg2+反应生成MgCO3,MgCO3的溶解度大于Mg(OH)2,故c错误;d、Mg2+能够转化成Mg(OH)2,故d正确;(5)得到ZnSO4·7H2O,一般采用方法是蒸发浓缩、冷却结晶;(6)Zn(OH)2中锌的物质的量为m2×103/99mol,根据原子守恒,棱锌矿中锌原子物质的量至少为m2×103/99mol,即ZnCO3的物质的量至少为m2×103/99mol,即质量为125×m2×103/99g,质量分数为
;(4)a、大理石不溶于水,无法让Mg2+转化成Mg(OH)2,故a错误;b、加入石灰乳,利用氢氧化镁比Ca(OH)2更难溶的性质,将Mg2+转化成Mg(OH)2,故b正确;c、纯碱与Mg2+反应生成MgCO3,MgCO3的溶解度大于Mg(OH)2,故c错误;d、Mg2+能够转化成Mg(OH)2,故d正确;(5)得到ZnSO4·7H2O,一般采用方法是蒸发浓缩、冷却结晶;(6)Zn(OH)2中锌的物质的量为m2×103/99mol,根据原子守恒,棱锌矿中锌原子物质的量至少为m2×103/99mol,即ZnCO3的物质的量至少为m2×103/99mol,即质量为125×m2×103/99g,质量分数为![]() 2
2![]() 1。
1。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列叙述正确的是
A. 11 g由![]() 和
和![]() 组成的超重水中,含有的中子数目为5NA
组成的超重水中,含有的中子数目为5NA
B. 常温下,1.0 LpH=13的Ba(OH)2溶液中含有的OH-数目为0.1 NA
C. 标准状况下.11.2 L乙烯中含有共用电子对的数目为NA
D. 常温下.56 g铁片投入足量浓H2SO4中生成NA个SO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红矾钠(Na2Cr2O7·2H2O)是重要的化工原料,工业上用铬铁矿(主要成分是FeO·Cr2O3)制备红矾钠的过程中会发生如下反应:4FeO(s)+4Cr2O3(s)+8Na2CO3(s)+7O2(g) ![]() 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
(1)请写出上述反应的化学平衡常数表达式:K=__________________。
(2)图1、图2表示上述反应在t1时达到平衡、在t2时因改变某个条件而发生变化的曲线。由图1判断,反应进行至t2时,曲线发生变化的原因是___________________(用文字表达);由图2判断,t2到t3的曲线变化的原因可能是________(填写序号)。
a.升高温度 b.加催化剂 c.通入O2 d.缩小容器体积

(3)工业上可用上述反应中的副产物CO2来生产甲醇:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①已知该反应能自发进行,则下列图像正确的是___________。

②在T1温度时,将1 mol CO2和3 mol H2充入一密闭容器中,反应达到平衡后,CO2转化率为α,则容器内平衡时的压强与起始压强之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的 SO2气体和 SO3气体相比较,正确的说法是
A. 密度比为 4:5 B. 物质的量之比为 4:5
C. 体积比为 1:1 D. 原子数之比为 3:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应从原理上不可以设计成原电池的是
①CaO+H2O=Ca(OH)2②NaOH+HCl═NaCl+H2O③2H2O═2H2+O2④2CO+O2═2CO2
A.①②B.①②③C.①②④D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预言,燃料电池将是21世纪获得电能的重要途径。近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下:

请回答下列问题:
(1)Pt(a)电极是电池的________极,电极反应式为__________________;Pt(b)电极发生________(填“氧化”或“还原”)反应,电极反应式为___________。
(2)电池的总反应方程式为____________________。
(3)如果该电池工作时电路中通过2 mol电子,则消耗的CH3OH有______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此改善能源结构、机动车限号等措施能有效减少PM2.5、SO2、NOx等污染。
请回答下列问题:
(1)将一定量的某利M2.5样品用蒸馏水溶解制成待测试样(忽略OH-)。常温下测得该训试样的组成及其浓度如下表:根据表中数据判断该试样的pH=___________。

(2)汽车尾气中NOx和CO的生成:①已知汽缸中生成NO的反应为:N2(g)+O2(g) ![]() 2NO(g)△H>0恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是____。
2NO(g)△H>0恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是____。
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2
D.氧气的转化率不再变化
(3)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)=H2O(g)△H=-241.8kJ·mol-1
C(s)+1/2O2(g)=CO(g)△H=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:_____________。
②洗涤含SO2的烟气。下列可作为洗涤含SO2的烟气的洗涤剂的是___________。
A.浓氨水 B.碳酸氢钠饱和溶液 C.FeCl2饱和溶液 D.酸性CaCl2饱和溶液
(4)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究性小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为______,在n(NO)/n(CO)=1的条件下,为更好的除去NOx物质,应控制的最佳温度在_____K左右。

(5)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃ 和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:

①写出NO与活性炭反应的化学方程式_____,②若T1<T2,则该反应的△H______O (填”>”、“<”或“=”)。
③上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来AIST报告正在研制一种“高容量、低成本”的锂—铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH一,下列说法不正确的是 ( )

A. 放电时,Li+透过固体电解质向Cu极移
B. 放电时,正极的电极反应式为O2+2H2O+4e一=4OH—
C. 通空气时,铜被腐蚀,表面产生Cu2O
D. 通空气时,整个反应过程中,铜相当于是催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林是一种解毒镇痛药。烃A是一种有机化工原料,下图是以它为初始原料设计合成阿司匹林关系图:
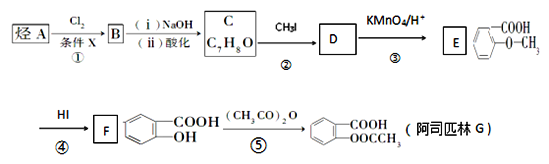
已知:(1)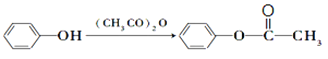
(2)烷基苯在高锰酸钾的作用下,侧链被氧化成羧基:![]()
(3)![]() (苯胺,易被氧化)
(苯胺,易被氧化)
请根据本题所给信息与所学知识回答下列问题:
(1)C的结构简式为__________________________
(2)反应④的反应类型________,在③之前设计②这一步的目的是_____________。
(3)F中含氧官能团的名称__________________________
(4)G(阿司匹林)与足量NaOH溶液反应的化学方程式为_____________________。
(5)符合下列条件的E的同分异构体有________种。写出核磁共振氢谱中有四组峰,峰面积之比为3:2:2:1的结构简式:________________(只写一种)。
a.苯环上有两个取代基
b.遇氯化铁溶液显紫色
c.能发生水解反应
(6)利用甲苯为原料,结合以上合成路线和信息合成功能高分子材料(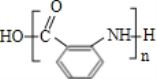 ,无机试剂任选)____________________
,无机试剂任选)____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com