
【题目】阿司匹林是一种解毒镇痛药。烃A是一种有机化工原料,下图是以它为初始原料设计合成阿司匹林关系图:
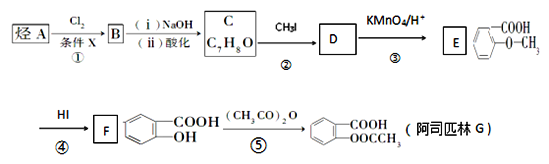
已知:(1)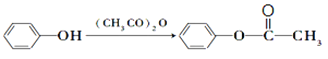
(2)烷基苯在高锰酸钾的作用下,侧链被氧化成羧基:![]()
(3)![]() (苯胺,易被氧化)
(苯胺,易被氧化)
请根据本题所给信息与所学知识回答下列问题:
(1)C的结构简式为__________________________
(2)反应④的反应类型________,在③之前设计②这一步的目的是_____________。
(3)F中含氧官能团的名称__________________________
(4)G(阿司匹林)与足量NaOH溶液反应的化学方程式为_____________________。
(5)符合下列条件的E的同分异构体有________种。写出核磁共振氢谱中有四组峰,峰面积之比为3:2:2:1的结构简式:________________(只写一种)。
a.苯环上有两个取代基
b.遇氯化铁溶液显紫色
c.能发生水解反应
(6)利用甲苯为原料,结合以上合成路线和信息合成功能高分子材料(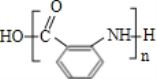 ,无机试剂任选)____________________
,无机试剂任选)____________________
【答案】  取代反应 保护酚羟基,防止酚羟基被氧化 羧基、酚羟基
取代反应 保护酚羟基,防止酚羟基被氧化 羧基、酚羟基 ![]() 9
9 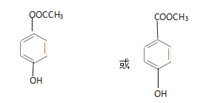
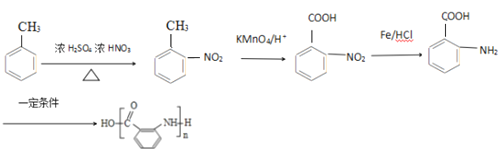
【解析】根据流程图,烃A与氯气发生取代反应生成卤代烃B,B在氢氧化钠溶液条件下水解生成醇C,根据C的化学式可知, A为甲苯,根据E的结构,结合已知信息(2)可知,D为![]() ,则C为
,则C为![]() ,因此B为苯环上的氢原子被取代的产物,反应条件为铁作催化剂。
,因此B为苯环上的氢原子被取代的产物,反应条件为铁作催化剂。
(1)根据上述分析,C为![]() ,故答案为:
,故答案为:![]() ;
;
(2)根据流程图,反应④为![]() 与HI反应生成
与HI反应生成![]() ,属于取代反应,在③之前设计②可以保护酚羟基,防止酚羟基被氧化,故答案为:取代反应;保护酚羟基,防止酚羟基被氧化;
,属于取代反应,在③之前设计②可以保护酚羟基,防止酚羟基被氧化,故答案为:取代反应;保护酚羟基,防止酚羟基被氧化;
(3)F(![]() )中含氧官能团有羧基、酚羟基,故答案为:羧基、酚羟基;
)中含氧官能团有羧基、酚羟基,故答案为:羧基、酚羟基;
(4)G(阿司匹林)中的酯基水解生成的是酚羟基,也能与氢氧化钠反应,与足量NaOH溶液反应的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(5)E为![]() ,a.苯环上有两个取代基;b.遇氯化铁溶液显紫色,说明含有酚羟基;c.能发生水解反应,说明含有酯基,满足条件的结构是:苯环上连接有1个羟基和1个—C2H3O2(含有酯基),—C2H3O2的结构有HCOOCH2—、CH3COO—、—COOCH3,因此满足条件的结构有3×3=9种;其中核磁共振氢谱中有四组峰,峰面积之比为3:2:2:1的结构简式为
,a.苯环上有两个取代基;b.遇氯化铁溶液显紫色,说明含有酚羟基;c.能发生水解反应,说明含有酯基,满足条件的结构是:苯环上连接有1个羟基和1个—C2H3O2(含有酯基),—C2H3O2的结构有HCOOCH2—、CH3COO—、—COOCH3,因此满足条件的结构有3×3=9种;其中核磁共振氢谱中有四组峰,峰面积之比为3:2:2:1的结构简式为![]() 或
或![]() ,故答案为:9;
,故答案为:9;![]() 或
或![]() ;
;
(6)甲苯合成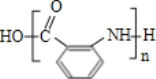 ,需要合成
,需要合成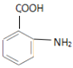 ,根据已知条件(3),可以由
,根据已知条件(3),可以由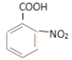 合成
合成 ,羧基可以有甲基氧化得到,因此合成路线为
,羧基可以有甲基氧化得到,因此合成路线为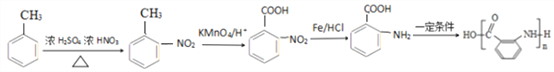 ,故答案为:
,故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是![]() ,并含少量的
,并含少量的![]() 、
、![]() 、MgO、CaO等,生产工艺流程图如下:
、MgO、CaO等,生产工艺流程图如下:
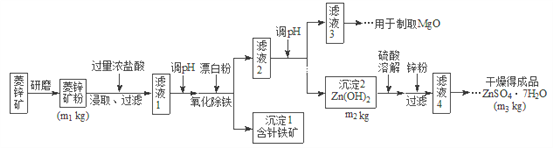
(1)将菱锌矿研磨成粉的目的是_______________。
(2)写出Fe3+水解的离子方程式_________________。
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为__________。
沉淀化学式 |
|
|
|
|
开始沉淀的pH |
|
|
|
|
沉淀完全的pH |
|
|
|
|
开始溶解的pH |
|
|
|
|
Ksp |
|
|
|
|
(4)工业上从“滤液3”制取MgO过程中,合适的反应物是________选填序号。
![]() 大理石粉
大理石粉 ![]() 石灰乳 c纯碱溶液 d氨水
石灰乳 c纯碱溶液 d氨水
(5)“滤液4”之后的操作依次为________、_______、过滤,洗涤,干燥。
(6)分析图中数据,菱锌矿粉中![]() 的质量分数不低于__________用代数式表示
的质量分数不低于__________用代数式表示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组开展下列实验探究活动:
(1)装置A 中反应的化学方程式为___________________________。
(2)利用装置A 中产生的气体设计实验证明+4价硫具有氧化性:___________________________。
(3)选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱。
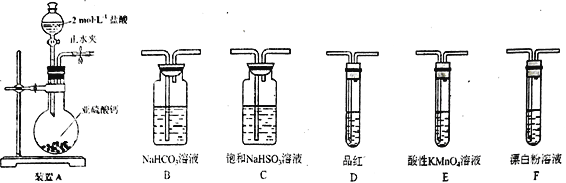
装置连接顺序为___________________________。通过___________________________现象即可证明亚硫酸的酸性强于次氯酸。
(4)利用G装置可测定装置A 液中SO2的含量。量取1.00 mL残液于烧瓶中,加适量的水稀释,加热使SO2全部逸出并与锥形瓶中H2O2完全反应(SO2+H2O2==H2SO4,然后用0.1000 mol/LNaOH 标准溶液进行滴定,至终点时消耗NaOH溶液20.00mL。
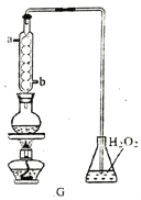
①残液中SO2含量为____________g·L-1
②经多次测定发现,测定值始终高于实验值,则其原因是___________________________。
(5)设计实验证明H2SO3为二元弱酸:___________________________。(可提供的仪器:pH计,其他中学化学常见仪器任选,药品:0.10mol·L-1NaOH溶液、0.05 mol·L-1H2SO3溶液,酸碱指示剂)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.氢氧化钠的摩尔质量是40g
B.1mol氢氧根离子的质量是17g
C.1mol氮的质量是14g/mol
D.氩气的摩尔质量就是它的相对原子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
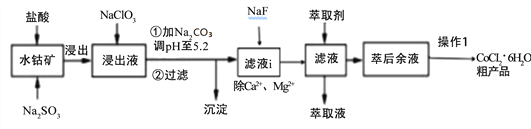
已知:①浸出液含有的阳离子主要有H+、Co2+、Ca2+、Mg2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl26H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方式_______________________________。
(2)NaClO3的作用是____________________写出该反应的离子方程式_____________;
若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体是 ___________(填化学式)。
(3)加Na2CO3调pH至5.2所得沉淀为________________。
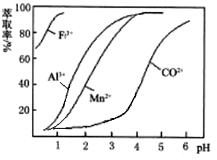
(4)萃取剂对金属离子的萃取率与pH的关系如下图。加萃取剂的目的是_______________;其使用的最佳pH范围是(填字母代号)__________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(5)操作I包含3个基本实验操作是蒸发、结晶和过滤.制得的CoCl26H2O需减压烘干的原因是______________________________。
(6)除“钙”“镁”是将滤液i中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.50×10-10。当加入过量NaF,所得滤液中c(Mg2+)/c(Ca2+)=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL 0.2mol/L草酸溶液中逐滴加入等浓度的NaOH溶液,溶液中各微粒的物质的量与混合溶液pH的关系如图所示,下列说法正确的是

A. 当V(NaOH溶液)<10mL时,溶液中可能存在:c(Na+)=2c(C2O42-)+c(HC2O4-)
B. 当V(NaOH溶液)=10mL时,溶液中水的电离程度比纯水大
C. 当V(NaOH溶液)=15mL时,溶液中存在: c(Na+)>c(HC2O4-)>c(C2O42-)
D. 当V(NaOH溶液)=20mL时,溶液中存在:c(OH-)=2c(H2C2O4)+c(H+)+c(HC2O4-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子中中心原子价层电子对几何构型为四面体且分子或离子空间的构型为V形的是( )
A. NH4+ B. PH3 C. H3O+ D. OF2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.

(1)指出图中明显的错误________________;________________;
(2)A仪器的名称是________________;B仪器的名称是________________;
(3)萃取、分液实验中所用主要玻璃仪器的名称是________________,静置后分液的第一步操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】罗马大学Fulvio Cacace等人获得了极具理论研究意义的N4分子,N4分子结构如右图所示(与白磷P4相似)。已知断裂1 mol N—N键吸收167 kJ热量,生成 1 mol N≡N键放出 942 kJ 热量。由此判断下列说法正确的是( )

A. N4属于一种新型的化合物 B. N4与N2互为同分异构体
C. N4沸点比P4(白磷)高 D. 1 mol N4气体转变为N2将放出882 kJ热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com