
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
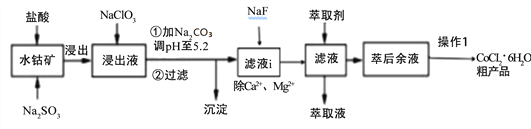
已知:①浸出液含有的阳离子主要有H+、Co2+、Ca2+、Mg2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl26H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方式_______________________________。
(2)NaClO3的作用是____________________写出该反应的离子方程式_____________;
若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体是 ___________(填化学式)。
(3)加Na2CO3调pH至5.2所得沉淀为________________。
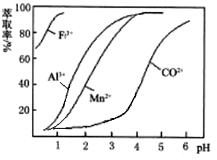
(4)萃取剂对金属离子的萃取率与pH的关系如下图。加萃取剂的目的是_______________;其使用的最佳pH范围是(填字母代号)__________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(5)操作I包含3个基本实验操作是蒸发、结晶和过滤.制得的CoCl26H2O需减压烘干的原因是______________________________。
(6)除“钙”“镁”是将滤液i中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.50×10-10。当加入过量NaF,所得滤液中c(Mg2+)/c(Ca2+)=_____________。
【答案】 Co2O3+SO32-+4H+=2Co2++SO42-+2H2O 将Fe2+氧化成Fe3+ ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O Cl2 Fe(OH)3 Al(OH)3 除去溶液中的Mn2+ B 降低烘干温度,防止产品分解 0.49
【解析】含钴废料中加入盐酸、Na2SO3后的浸出液含有的阳离子主要有H+、Co2+、Ca2+、Mg2+、Fe2+、Mn2+、Al3+等,加入NaClO3,可以将Fe2+氧化得到Fe3+,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液中加入NaF除去Ca2+、Mg2+,在用萃取剂萃取,得到的溶液中主要含有CoCl2,为得到CoCl26H2O晶体,应控制温度在86℃以下,加热时要防止温度过高而失去结晶水,可减压烘干。
(1)酸性条件下,Co2O3和SO32-发生氧化还原反应生成Co2+、SO42-,反应离子方程式为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O,故答案为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O;
(2)酸性条件下,加入NaClO3将Fe2+氧化为Fe3+,便于调节pH转化氢氧化铁沉淀而除去,反应的离子方程式为ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,若不慎向“浸出液”中加过量NaClO3时,氯酸钠能够氧化氯离子反应生成氯气,故答案为:将Fe2+氧化为Fe3+;ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;Cl2;
(3)“加Na2CO3调pH至a”,目的是除去铁离子、铝离子,将铁离子、铝离子转化为Fe(OH)3、Al(OH)3沉淀,过滤除去,故答案为:Fe(OH)3、Al(OH)3;
(4)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子,由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液pH在3.0~3.5之间,可使Mn2+被萃取,并防止Co2+被萃取,故答案为:除去溶液中的Mn2+;B;
(5)操作I包含3个基本实验操作是蒸发、结晶和过滤,制得的CoCl26H2O需减压烘干,目的是降低烘干温度,防止产品分解,故答案为:降低烘干温度,防止产品分解;
(6)由溶度积可知,滤液i“除钙、镁”是将溶液中Ca2+与Mg2+转化为CaF2、MgF2沉淀,根据溶度积可知c(Mg2+):c(Ca2+)=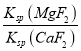 =
=![]() =0.49,故答案为:0.49。
=0.49,故答案为:0.49。


科目:高中化学 来源: 题型:
【题目】下列反应从原理上不可以设计成原电池的是
①CaO+H2O=Ca(OH)2②NaOH+HCl═NaCl+H2O③2H2O═2H2+O2④2CO+O2═2CO2
A.①②B.①②③C.①②④D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是元素周期表的一部分,已知A、B、C、D、E、F、G都是周期表中的前四周期元素,它们在周期表中的位置如图1所示。
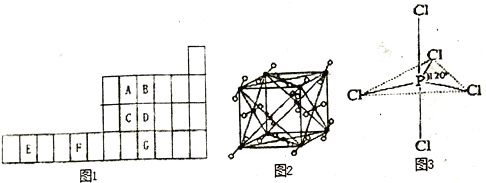
试回答下列问题:
(1)F元素基态原子的核外电子排布式为_________________。
(2)ABC的第一电离能由大到小的顺序______________(用元素符号表示)。
(3)B元素单质分子中的_______个π键,与其互为等电子体的阴离子为____________________。
(4)图2为A元素某种氧化物的晶胞,其分子中心原子采用________杂化,每个分子周围有_____个分子与之距离相等且最近。若晶胞棱长为apm,则该晶体密度的表达式为________g·cm-3。
(5)G元素的氢化物分子的空间构型为________,其沸点与B元素的氢化物相比________ (填高或低),其原因是________ 。
(6)向CuSO4溶液中滴加入B元素氢化物的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解,得到深蓝色透明溶液,请写出沉淀溶解的离子方程式________ 。
(7)知道B的电负性大于氯,则B与F2或Cl2形成的化合物水解,产物是否相同__________?(填“相同”或“不同”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5 mol SO2共约含有_____个原子,它与______gSO3所含硫原子数相等。
(2)3.6gNH4+共约含有_____个电子,共约含有_____个中子
(3)质量相同的 ①HCl、②NH3、③CO2、④O2四种气体中,含有分子数目最少的是(填序号)___________________。
(4)有100mL 0.2 mol/L 的NaOH溶液,将此溶液稀释到200 mL,则溶液中Na+的物质的量是__________ 。将稀释后的溶液与300 mL 0.4 mol/L 的NaOH溶液混合后,Na+的物质的量浓度是__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类正确的是( )
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | Na2CO3 | H2SO4 | Cu(OH)2CO3 | Fe2O3 | SO3 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | NaOH | NaHSO4 | CaF2 | MgO | SO2 |
D | KOH | HNO3 | NaHCO3 | CaO | CO2 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
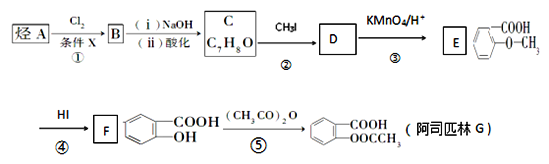
【题目】阿司匹林是一种解毒镇痛药。烃A是一种有机化工原料,下图是以它为初始原料设计合成阿司匹林关系图:
已知:(1)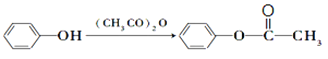
(2)烷基苯在高锰酸钾的作用下,侧链被氧化成羧基:![]()
(3)![]() (苯胺,易被氧化)
(苯胺,易被氧化)
请根据本题所给信息与所学知识回答下列问题:
(1)C的结构简式为__________________________
(2)反应④的反应类型________,在③之前设计②这一步的目的是_____________。
(3)F中含氧官能团的名称__________________________
(4)G(阿司匹林)与足量NaOH溶液反应的化学方程式为_____________________。
(5)符合下列条件的E的同分异构体有________种。写出核磁共振氢谱中有四组峰,峰面积之比为3:2:2:1的结构简式:________________(只写一种)。
a.苯环上有两个取代基
b.遇氯化铁溶液显紫色
c.能发生水解反应
(6)利用甲苯为原料,结合以上合成路线和信息合成功能高分子材料(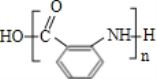 ,无机试剂任选)____________________
,无机试剂任选)____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把下列四种X溶液,分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,并加水稀释到50 mL。此时X和盐酸缓慢地进行反应,其中反应速率最快的是
A. 20 mL 3 mol·L-1 B. 20 mL 2 mol·L-1
C. 10 mL 4 mol·L-1 D. 10 mL 2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述可能正确的是
A. 增大了反应的活化能 B. 增大了反应的速率
C. 降低了反应的焓变 D. 增大了反应的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含手性碳原子的分子称手性分子,手性分子具有光学活性。如下图有机物具有光学活性(式中标有*号的为手性碳原子),也能发生下列反应,请问发生哪种反应后,该有机物仍然一定具有光学活性( )
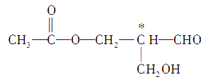
A. 消去反应 B. 水解反应 C. 银镜反应 D. 酯化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com