
【题目】图1是元素周期表的一部分,已知A、B、C、D、E、F、G都是周期表中的前四周期元素,它们在周期表中的位置如图1所示。
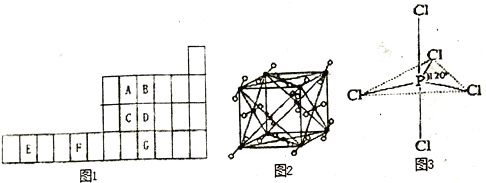
试回答下列问题:
(1)F元素基态原子的核外电子排布式为_________________。
(2)ABC的第一电离能由大到小的顺序______________(用元素符号表示)。
(3)B元素单质分子中的_______个π键,与其互为等电子体的阴离子为____________________。
(4)图2为A元素某种氧化物的晶胞,其分子中心原子采用________杂化,每个分子周围有_____个分子与之距离相等且最近。若晶胞棱长为apm,则该晶体密度的表达式为________g·cm-3。
(5)G元素的氢化物分子的空间构型为________,其沸点与B元素的氢化物相比________ (填高或低),其原因是________ 。
(6)向CuSO4溶液中滴加入B元素氢化物的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解,得到深蓝色透明溶液,请写出沉淀溶解的离子方程式________ 。
(7)知道B的电负性大于氯,则B与F2或Cl2形成的化合物水解,产物是否相同__________?(填“相同”或“不同”)。
【答案】 1s22s22p63s23p63d104s1 N>C>Si 2 CN sp 12 ![]() 176/[NA×(a×10-10)3] 三角锥形 低 NH3分子之间存在氢键 Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O 不同
176/[NA×(a×10-10)3] 三角锥形 低 NH3分子之间存在氢键 Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O 不同
【解析】(1)F的原子序数为29,是铜元素,其核外电子排布式为1s22s22p63s23p63d104s1。
(2)A、B、C元素分别为碳、氮、硅元素,碳与硅同一主族,碳的第一电离能大于硅的第一电离能,N的2p轨道是半充满结构,属于稳定结构,故氮的第一电离能大于碳的第一电离能,所以第一电离能由大到小的顺序为N>C>Si。
(3)N2分子中是氮氮叁键,含有2个π键;等电子体是原子个数相同、电子总数也相同的粒子间的互称,N2含有14个电子,故与其为等电子体的阴离子为CN-或者C22-。
(4)A为碳元素,根据图示可知该分子为CO2,CO2为直线型分子,中心碳原子采取sp杂化;以顶角的CO2为标准,与它最近的CO2分子位于面心,共有12个;一个晶胞中实际含有的CO2分子个数为8×1/8+6×1/2=4,晶包的体积为(a×10-10)3cm3,所以晶体的密度=44÷NA×4÷(a×10-10)3=176/【NA×(a×10-10)3】g·cm-3。
(5)G为As元素,氢化物为AsH3,分子空间构型与NH3相同,为三角锥形;氨气分子间可以形成氢键,AsH3分子间只有分子间作用力,所以AsH3的沸点低于NH3的沸点。故答案为:三角锥、低、NH3分子之间存在氢键。
(6)CuSO4溶液中加入氨气水溶液,先生成Cu(OH)2沉淀,Cu(OH)2的Cu离子有4个空轨道,而氨气分子中的N原子有未成对电子,故两者可以形成配位键,从而Cu(OH)2溶解在氨水中,离子方程式为:Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O。
(7)N元素的电负性小于F的,所以NF3中N为+3价,F为-1价,与水的水解反应即复分解反应,水解产物为HF和HNO2;N的电负性大于Cl的电负性,所以在NCl3中,N为-3价,Cl为+1价,水解的产物为NH3和HClO,故两者水解的产物不同。


科目:高中化学 来源: 题型:
【题目】化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq)下列有关叙述中正确的是( )
CuS(s)+Mn2+(aq)下列有关叙述中正确的是( )
①MnS的Ksp大于CuS的Ksp ②达到平衡时c(Mn2+)=c(Cu2+) ③溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Mn2+)保持不变 ④该反应平衡常数K=
A. ①④ B. ②③
C. ①②③ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次增大的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A. 原子半径:W>Z>Y>X>M
B. 常见气态氢化物的稳定性:X<Y<Z
C. 1 mol WM溶于足量水中完全反应,共转移2 mol电子
D. 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[一lg c(M2+)]与溶液pH的变化关系如图所示,已知该温度下,Ksp[Cu(OH)2]2],下列说法正确的是 ( )

A. b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1
B. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中:C(Fe2+):C(Cu2+):1:104.6
C. 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
D. 除去CuSO4溶液中含有的少量Fe2+,可加入适量Cu0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组开展下列实验探究活动:
(1)装置A 中反应的化学方程式为___________________________。
(2)利用装置A 中产生的气体设计实验证明+4价硫具有氧化性:___________________________。
(3)选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱。
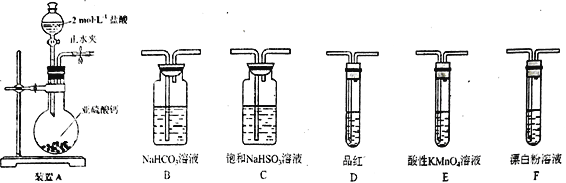
装置连接顺序为___________________________。通过___________________________现象即可证明亚硫酸的酸性强于次氯酸。
(4)利用G装置可测定装置A 液中SO2的含量。量取1.00 mL残液于烧瓶中,加适量的水稀释,加热使SO2全部逸出并与锥形瓶中H2O2完全反应(SO2+H2O2==H2SO4,然后用0.1000 mol/LNaOH 标准溶液进行滴定,至终点时消耗NaOH溶液20.00mL。
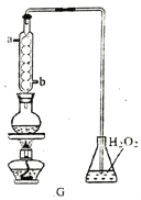
①残液中SO2含量为____________g·L-1
②经多次测定发现,测定值始终高于实验值,则其原因是___________________________。
(5)设计实验证明H2SO3为二元弱酸:___________________________。(可提供的仪器:pH计,其他中学化学常见仪器任选,药品:0.10mol·L-1NaOH溶液、0.05 mol·L-1H2SO3溶液,酸碱指示剂)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来我国科技发展突飞猛进。下列设备工作时主要由化学能转化为电能的是
A.海上风力发电
B.“深海勇士”号潜水器的新型锂电池
C.北斗导航卫星的太阳能电池板
D.“长征5号”火箭使用的煤油液氧发动机
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
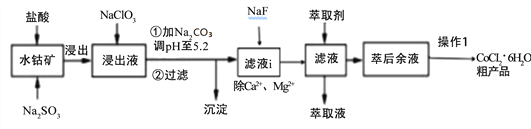
已知:①浸出液含有的阳离子主要有H+、Co2+、Ca2+、Mg2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl26H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方式_______________________________。
(2)NaClO3的作用是____________________写出该反应的离子方程式_____________;
若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体是 ___________(填化学式)。
(3)加Na2CO3调pH至5.2所得沉淀为________________。
(4)萃取剂对金属离子的萃取率与pH的关系如下图。加萃取剂的目的是_______________;其使用的最佳pH范围是(填字母代号)__________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
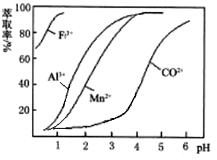
(5)操作I包含3个基本实验操作是蒸发、结晶和过滤.制得的CoCl26H2O需减压烘干的原因是______________________________。
(6)除“钙”“镁”是将滤液i中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.50×10-10。当加入过量NaF,所得滤液中c(Mg2+)/c(Ca2+)=_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com