
【题目】下列变化化学键未被破坏的是( )
A.HCl溶于水B.NaOH固体熔化
C.NH4HCO3分解D.碘升华
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】图1是元素周期表的一部分,已知A、B、C、D、E、F、G都是周期表中的前四周期元素,它们在周期表中的位置如图1所示。
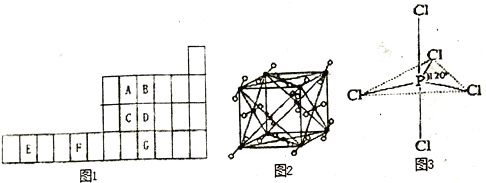
试回答下列问题:
(1)F元素基态原子的核外电子排布式为_________________。
(2)ABC的第一电离能由大到小的顺序______________(用元素符号表示)。
(3)B元素单质分子中的_______个π键,与其互为等电子体的阴离子为____________________。
(4)图2为A元素某种氧化物的晶胞,其分子中心原子采用________杂化,每个分子周围有_____个分子与之距离相等且最近。若晶胞棱长为apm,则该晶体密度的表达式为________g·cm-3。
(5)G元素的氢化物分子的空间构型为________,其沸点与B元素的氢化物相比________ (填高或低),其原因是________ 。
(6)向CuSO4溶液中滴加入B元素氢化物的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解,得到深蓝色透明溶液,请写出沉淀溶解的离子方程式________ 。
(7)知道B的电负性大于氯,则B与F2或Cl2形成的化合物水解,产物是否相同__________?(填“相同”或“不同”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把下列四种X溶液,分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,并加水稀释到50 mL。此时X和盐酸缓慢地进行反应,其中反应速率最快的是
A. 20 mL 3 mol·L-1 B. 20 mL 2 mol·L-1
C. 10 mL 4 mol·L-1 D. 10 mL 2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述可能正确的是
A. 增大了反应的活化能 B. 增大了反应的速率
C. 降低了反应的焓变 D. 增大了反应的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
![]()
(1)加入过量BaCl2目的是__________________________________。
(2)第④步中,相关的化学方程式是_______________________________________。
(3)配制NaCl溶液时,若出现下列操作,其结果偏高还是偏低?
A.称量时NaCl已潮解(______)
B.天平的砝码已锈蚀(______)
C.定容摇匀时,液面下降又加水(______)
D.定容时俯视刻度线(______)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点231.9℃)与Cl2反应制备SnCl4,装置如下图所示。
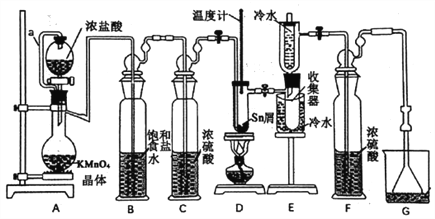
已知:①SnCl2、SnCl4有关物理性质如下表
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
②SnCl4在空气中极易水解生成SnO2·xH2O。
回答下列问题:
(1)导管a的作用是____________,装置A中发生反应的离子方程式为___________。
(2)当观察到装置F液面上方出现___________现象时才开始点燃酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的是___________、___________。
(3)若上述装置中缺少装置C(其它均相同),则D处具支试管中发生的主要副反应化学方程式为___________ 。
(4)若制得产品中含有少量Cl2,则可采用下列___________(填字母)措施加以除去。
A.加入NaOH萃取分液 B.加入足量锡再加热蒸馏
C.加入碘化钾冷凝过滤 D.加入饱和食盐水萃取
(5)可用碘量法测定最后产品的纯度,发生如下反应:Sn2++I2=Sn4++2Iˉ。准确称取该样品m g放于锥形瓶中,用少量浓盐酸溶解,再加水稀释,淀粉溶液作指示剂,用0.1mol·L-1碘标准溶液滴定至终点,消耗标准液20.00mL,则产品中SnCl2的含量为___________(用含m的代数式表示);即使此法测定的操作均正确,但测得的SnCl4含量仍高于实际含量,其原因可能是___________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含手性碳原子的分子称手性分子,手性分子具有光学活性。如下图有机物具有光学活性(式中标有*号的为手性碳原子),也能发生下列反应,请问发生哪种反应后,该有机物仍然一定具有光学活性( )
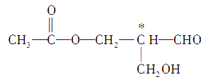
A. 消去反应 B. 水解反应 C. 银镜反应 D. 酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①1L0.1mol/LNH4NO3溶液中氮原子数小于0.2NA
②用标准盐酸滴定NaOH 溶液测其浓度时,酸式滴定管用蒸馏水洗涤后,没用标准盐酸润洗,直接装标准盐酸滴定,所测的碱液浓度偏低
③PH相等的四种溶液: a.CH3COONa b.C6H5ONa c.NaHCO3 d.NaOH。(已知酸性:C6H5OH2CO3),其溶液物质的量浓度由小到大顺序为:d、b、c、a
④钢铁腐蚀时可能发生的正极反应: 2H2O+O2+4e-=4OH-
⑤电解饱和MgCl2溶液时,电解反应式为:2H2O+2Cl-![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
⑥在海轮外壳连接锌块保护外壳不受腐蚀是采用牺牲阳极的阴极保护法
⑦长期使用硫酸铵,土壤酸性增强:草木灰与铵态氮肥不能混合施用
A. ①②⑤⑥ B. ①③⑤⑦ C. ②③④⑤ D. ③④⑥⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com