
【题目】把下列四种X溶液,分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,并加水稀释到50 mL。此时X和盐酸缓慢地进行反应,其中反应速率最快的是
A. 20 mL 3 mol·L-1 B. 20 mL 2 mol·L-1
C. 10 mL 4 mol·L-1 D. 10 mL 2 mol·L-1
科目:高中化学 来源: 题型:
【题目】化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq)下列有关叙述中正确的是( )
CuS(s)+Mn2+(aq)下列有关叙述中正确的是( )
①MnS的Ksp大于CuS的Ksp ②达到平衡时c(Mn2+)=c(Cu2+) ③溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Mn2+)保持不变 ④该反应平衡常数K=
A. ①④ B. ②③
C. ①②③ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来我国科技发展突飞猛进。下列设备工作时主要由化学能转化为电能的是
A.海上风力发电
B.“深海勇士”号潜水器的新型锂电池
C.北斗导航卫星的太阳能电池板
D.“长征5号”火箭使用的煤油液氧发动机
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
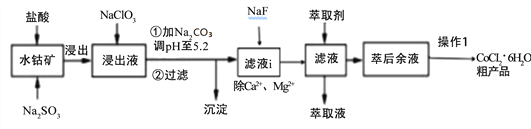
已知:①浸出液含有的阳离子主要有H+、Co2+、Ca2+、Mg2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl26H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方式_______________________________。
(2)NaClO3的作用是____________________写出该反应的离子方程式_____________;
若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体是 ___________(填化学式)。
(3)加Na2CO3调pH至5.2所得沉淀为________________。
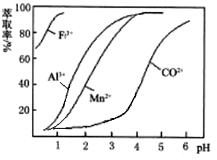
(4)萃取剂对金属离子的萃取率与pH的关系如下图。加萃取剂的目的是_______________;其使用的最佳pH范围是(填字母代号)__________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(5)操作I包含3个基本实验操作是蒸发、结晶和过滤.制得的CoCl26H2O需减压烘干的原因是______________________________。
(6)除“钙”“镁”是将滤液i中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.50×10-10。当加入过量NaF,所得滤液中c(Mg2+)/c(Ca2+)=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系从小到大表示不正确的是
A.氢原子数:②<④<③<① B.密度:①<④<③<②
C.质量:④<①<③<② D.体积:④<①<②<③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子中中心原子价层电子对几何构型为四面体且分子或离子空间的构型为V形的是( )
A. NH4+ B. PH3 C. H3O+ D. OF2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种物质均易溶于水,分别按下列条件配成溶液,其中物质的量浓度最大的是
A. 0.1 moL D物质溶于100 mL 2.5 mol·L-1的D溶液中
B. 9.2 g B物质(式量为46)溶于水配成100 mL溶液
C. 1.806×1023个C的分子溶于水配成100 mL溶液
D. 10 mL 5mol·L-1的A溶液加水配制成100 mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性强弱:I- >Fe2+。往100 mL碘化亚铁溶液中缓慢通入3.36 L(标准状况)氯气,反应完成后溶液中有1/2的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量浓度为
A. 1.1mol·L-1 B. 1.5mol·L-1 C. 1.2mol·L-1 D. 1.0mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com