
【题目】将如图中的K闭合,下列判断正确的是( )

A.去掉盐桥,此装置也能正常工作
B.盐桥中的K+向盛有硫酸铜溶液的烧杯移动,高锰酸根离子向b移动
C.一段时间后,硫酸铜溶液浓度减小
D.C极上的电极反应式为Fe3++e-=Fe2+
【答案】D
【解析】
原电池的构造原理要求装置能够形成闭合回路,盐桥在此使两个烧杯连接,形成闭合回路,据此分析;该原电池中Cu为负极,失电子形成铜离子,C为正极,铁离子得电子生成亚铁离子;因此b为电解池的负极,a为正极,电解池中阳离子向负极移动,阴离子向正极移动,据以上分析进行解答。
A、去掉盐桥,不能形成闭合回路,此装置不能正常工作,故A错误;
B、C极为原电池的正极,钾离子向盛有硫酸铁溶液的烧杯移动,a为电解池的阳极,高锰酸根离子向a移动,故B错误;
C、因为铜极发生氧化反应,极反应为Cu-2e-=Cu2+,所以溶液中铜离子浓度增大,故C错误;
D、C极为原电池正极,发生还原反应,极反应为Fe3++e-=Fe2+,故D正确;
故答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】a、b、c、d、e五种短周期元素的原子序数逐渐增大。a为非金属元素,且a、e同主族,c、d为同周期的相邻元素。e原子的质子数等于c、d原子最外层电子数之和。b原子最外层电子数是内层电子数的2倍。c的气态氢化物分子中有3个共价键。试推断:
(1)写出b元素在周期表中的位置__________;
(2)写出一种由a、c、d所形成的离子化合物__________ (化学式),它与e的最高价氧化物对应水化物的溶液加热时反应的离子方程式是_____________________;
(3)c的单质的电子式为__________。
(4)b和d相比,非金属性较强的是__________ (用元素符号表示),下列事实能证明这一结论的是___(选填字母序号)。
A.常温下,b的单质呈固态,d的单质呈气态
B.d的氢化物的稳定性强于b的氢化物
C.b与d形成的化合物中,b呈正价
D.d的氢化物的沸点高于b的氢化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在一定条件下可以合成乙醇(CH3CH2OH):2CO(g)+4H2(g) ![]() CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到平衡状态的是( )
CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到平衡状态的是( )
A.CO全部转化为乙醇
B.反应体系中乙醇的物质的量浓度不再变化
C.正反应和逆反应的化学反应速率均为零
D.CO和H2以1:2的物质的量之比反应生成乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们在实验室模拟工业制氨的过程,以探究外界条件对平衡的影响。
查阅资料,获得以下键能数据:
化学键 | N≡N | H-H | N-H |
键能/(kJ/mol) | 946 | 436 | 391 |
(1)计算工业合成氨反应的反应热:N2(g)+3H2(g)![]() 2NH3(g) △H=________kJ/mol
2NH3(g) △H=________kJ/mol
(2)一定温度下,向一个恒压容器中充入N2 0.6mol,H2 0.5mol,在一定温度下进行反应:N2(g)+3H2(g)![]() 2NH3(g),达到平衡时,N2的转化率为1/6,此时容器的体积为1L。
2NH3(g),达到平衡时,N2的转化率为1/6,此时容器的体积为1L。
①该温度时容器中平衡体系的平衡常数是________。
②若保持平衡时的温度和压强不变,继续向平衡体系中通入氖气,则平衡将____(填“正向”,“逆向”或“不”)移动。
(3)在两个压强相等,温度分别为T1和T2的容器中充入由1molN2和3molH2组成的混合气体,发生反应N2(g)+3H2(g)![]() 2NH3(g),平衡后改变容器体积,容器内 N2的体积分数随压强的变化如图所示。据图判断下列说法正确的是____(填标号)。
2NH3(g),平衡后改变容器体积,容器内 N2的体积分数随压强的变化如图所示。据图判断下列说法正确的是____(填标号)。
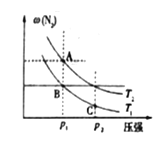
a.A、B、C三点的平衡常数大小关系:KA<KB<KC
b.A点和B点混合气体的密度大小关系:A<B
c.A点和C点混合气体的平均相对分子质量大小关系:A>C
(4)合成氨工业会产生大量副产物CO2,工业上常用高浓度的K2CO3溶液吸收CO2得溶液X,再利用电解法使K2CO3溶液再生,其装置如图所示:
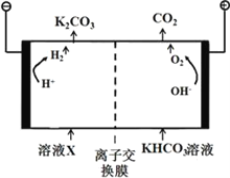
①在阳极区发生的反应包括____________________和H++ HCO3-=H2O+CO2↑。
②简述CO32-在阴极区再生的原理___________________________。
③再生装置中产生的CO2和H2在一定条件下反应生成甲醇,
工业上利用该反应合成甲醇。已知:25℃,101KPa下:
2H2(g)+O2(g)=2H2O(g) ΔH1=—484kJ/mol
2CH3OH(g)+3O2(g)=2CO2 (g)+4H2O(g) ΔH2=—1352kJ/mol
写出CO2和H2生成1molCH3OH(g)的热化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种高效消毒剂,可用如下反应制得:2NaClO3+Na2SO3+H2SO4![]() 2ClO2↑+2Na2SO4+H2O,下列说法正确的是( )
2ClO2↑+2Na2SO4+H2O,下列说法正确的是( )
A. 该反应属于复分解反应
B. NaClO3被还原,发生还原反应
C. 反应中Na2SO3作氧化剂
D. 生成6.75 g ClO2时,转移0.2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表格中各项分类都正确的一组是
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 冰水混合物 | 明矾 | 液态 | 蔗糖 |
B | CaO | 海水 | 铜 | 乙醇 |
C | 胆矾 | 镁合金 | AgCl |
|
D | 氢氧化钠 | 空气 |
| 食醋 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“侯氏制碱法”是我国化工专家候德榜为世界制碱工业作出的突出贡献。某实验小组模拟“侯氏制碱法”的工艺流程及实验装置(部分夹持装置省略)如下:

下列叙述错误的是
A. 实验时先点燃装置①的酒精灯,过一段时间后再打开装置③中分液漏斗的旋塞
B. 装置②的干燥管中可盛放蘸稀硫酸的脱脂棉,作用是吸收多余的NH3
C. 向步骤Ⅰ所得滤液中通入氨气,加入细小的食盐颗粒并降温,可析出NH4Cl
D. 用装置④加热碳酸氢钠可实现步骤Ⅱ的转化,所得CO2可循环使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二铬可用作搪瓷、陶瓷、人造革、建筑材料的着色剂。由高碳铬铁合金(含Cr、Fe及C)制备三氧化二铬的工艺流程如下:

已知:Cr(OH)3是两性氢氧化物,草酸亚铁为微溶物。
回答下列问题:
(1)步骤Ⅰ浸取时,为提高浸取速率,除将高碳铬铁合金制成粉末外,还可采取的措施是__________________________(写一点);浸取铬时反应的离子方程式为_______________。
(2)步骤Ⅱ滤渣返回再次浸取的目的是_____________________________________________。
(3)步骤Ⅲ除铁时,溶液的pH对铁的去除率影响如图1所示:

图1 图2
pH小于2.3时,铁去除率低,其原因是_______________________________________。
(4)步骤Ⅳ能说明沉淀已洗涤干净的操作是________________________________________。
(5)步骤Ⅴ沉铬时,生成Cr(OH)3的化学方程式为_____________________________;沉铬时,溶液pH与铬的回收率关系如图2所示,当pH>8.5时,pH越大,铬的回收率越低,其可能原因是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如表所示,下列说法不正确的是
物质 | X | Y | Z | W |
初始浓度/mol·L-1 | 0.5 | 0.5 | 0 | 0 |
平衡浓度/mol·L-1 | 0.1 | 0.1 | 0.4 | 0.4 |
A. 反应达到平衡时,X的体积分数为10%
B. 该温度下反应的平衡常数K=16
C. 保持温度不变增大压强,反应速率加快,平衡向正反应方向移动
D. 若X、Y的初始浓度均为0.8 mol·L-1,则达到平衡时,W的浓度为0.64 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com