
常温下,用 0.1 mol·L—1HCl溶液滴定10.0 mL浓度为0.1 mol·L—1 Na2CO3溶液,所得滴定曲线如右图所示。下列说法正确的是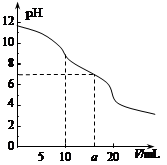
| A.当V=0时:c(H+)+c(HCO 3-)+c(H2CO3)=c(OH-) |
| B.当V=5时:c(CO32—)+c(HCO 3-)+c(H2CO3)=2c(Cl-) |
| C.当V=10时:c(Na+)>c(HCO 3-)>c(CO32—)>c(H2CO3) |
| D.当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-) |
科目:高中化学 来源: 题型:单选题
将氯化铝溶液蒸干并灼烧后得到纯净的固体A,将A在高温下熔融后用铂电极进行电解,下列有关电极产物的判断正确的是
| A.阴极产物是氢气 | B.阳极产物是氧气 |
| C.阴极产物是铝和氧气 | D.阳极产物只有氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对水垢的主要成分是CaCO3和Mg(OH)2而不是CaCO3和MgCO3的解释,说法正确的是( )
| A.Mg(OH)2的溶度积大于MgCO3的溶度积,且在水中发生了沉淀转化 |
| B.Mg(OH)2比MgCO3更难溶,且在水中发生了沉淀转化 |
C.MgCO3电离出的CO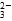 发生水解,使水中OH-浓度减小,对Mg(OH)2沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀 发生水解,使水中OH-浓度减小,对Mg(OH)2沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀 |
D.MgCO3电离出的CO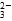 发生水解,促进水中OH-浓度增大,对Mg(OH)2沉淀溶解平衡而言,Qc>Ksp,生成Mg(OH)2沉淀 发生水解,促进水中OH-浓度增大,对Mg(OH)2沉淀溶解平衡而言,Qc>Ksp,生成Mg(OH)2沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在氯化铵溶液中,下列关系式正确的是( )
| A.c(Cl-)>c(N)>c(H+)>c(OH-) | B.c(N)>c(Cl-)>c(H+)>c(OH-) |
| C.c(Cl-)=c(N)>c(H+)=c(OH-) | D.c(N)=c(Cl-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,柠檬酸水溶液的pH是3,食用醋的pH是2,可乐的pH是6,三种物质的溶液中c(OH-)分别是( )
| A.1×10-11 mol·L-1,1×10-12 mol·L-1,1×10-8 mol·L-1 |
| B.1×10-11 mol·L-1,1×10-8 mol·L-1,1×10-12 mol·L-1 |
| C.2×10-11 mol·L-1,1×10-10 mol·L-1,1×10-8 mol·L-1 |
| D.1×10-8 mol·L-1,1×10-11 mol·L-1,1×10-12 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是( )
| A.Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O |
| B.Cu2++H2S=CuS↓+2H+ |
| C.Zn2++S2-+2H2O=Zn(OH)2↓+H2S↑ |
| D.FeS+2H+=Fe2++H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25 ℃时,PbCl2固体在不同浓度盐酸中的溶解度如图。在制备PbCl2的实验中,洗涤PbCl2固体最好选用( )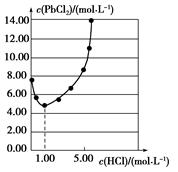
| A.蒸馏水 |
| B.1.00 mol·L-1盐酸 |
| C.5.00 mol·L-1盐酸 |
| D.10.00 mol·L-1盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
测得醋酸甲的pH:a,醋酸乙的pH:a+1。下列推断中正确的是( )
| A.醋酸甲中H+的物质的量是醋酸乙中的10倍 |
| B.醋酸乙的电离程度比醋酸甲大 |
| C.中和等物质的量的NaOH溶液需甲、乙两酸的体积之比为10∶1 |
| D.甲、乙溶液加水稀释,当pH相等时甲需加更多的水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com