
【题目】肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池等方面,NO2的二聚体N2O4是火箭中常用的氧化剂。请回答下列问题:

(1)肼燃料电池的原理如图1所示,左边电极上发生反应的电极反应式为 。
(2)火箭常用N2O4作氧化剂,肼作燃料,已知:
① N2(g)+2O2(g)![]() 2NO2(g) ΔH1=67.7 kJ·mol1;
2NO2(g) ΔH1=67.7 kJ·mol1;
② N2H4(g)+O2(g)![]() N2(g)+2H2O(g) ΔH2=534.0 kJ·mol1;
N2(g)+2H2O(g) ΔH2=534.0 kJ·mol1;
③2NO2(g)![]() N2O4(g) ΔH3=52.7 kJ·mol1。
N2O4(g) ΔH3=52.7 kJ·mol1。
气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式为 。
(3)联氨在工业生产中常以氨和次氯酸钠为原料获得,也可在高锰酸钾作催化剂条件下,用尿素[CO(NH2)2]和次氯酸钠、氢氧化钠溶液反应获得,尿素法反应的离子方程式为 。
(4)某模拟“人工树叶”的电化学实验装置如图2所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。该装置工作时,H+从 (填字母,后同)极区向 极区迁移,将电能转化为 能,每生成1 mol O2,有 g CO2被还原(小数点后保留1位数字)。
(5)图3中甲装置为C3H8O的燃料电池(电解质溶液为KOH溶液)装置,该同学想在乙装置中实现铁上镀铜,则f处通 ,写出电极c上的电极反应式: 。

【答案】(1)N2H44e+4OH![]() N2+4H2O
N2+4H2O
(2)2N2H4(g)+N2O4(g) ![]() 3N2(g)+4H2O(g) ΔH=947.6 kJ·mol1
3N2(g)+4H2O(g) ΔH=947.6 kJ·mol1
(3)CO(NH2)2+ClO+2OH![]() N2H4↑+
N2H4↑+![]() +Cl+H2O
+Cl+H2O
(4)b a 化学能 29.3
(5)O2 C3H8O 18e + 24OH![]() 3
3![]() +16H2O
+16H2O
【解析】(1)由图1可知燃料电池左边是N2H4生成N2和H2O,N化合价升高,N2H4失去电子发生氧化反应。
(2)由盖斯定律知,②×2①③可得2N2H4(g)+N2O4(g)![]() 3N2(g)+4H2O(g) ΔH=947.6 kJ·mol1。
3N2(g)+4H2O(g) ΔH=947.6 kJ·mol1。
(3)ClO作氧化剂,被尿素还原成Cl,尿素则被氧化为联氨,再根据原子个数守恒,即可写出离子方程式。
(4)由图2知,该装置为电解池,将电能转化为化学能,该装置工作时,在b极(阳极)H2O失去电子被氧化为O2,同时产生H+,H+从b极区向a极(阴极)区移动,由得失电子守恒知,每生成1 mol O2转移4 mol e,每消耗1 mol CO2转移6 mol e,则被还原的CO2的质量为![]() mol×44 g·mol1≈29.3 g。
mol×44 g·mol1≈29.3 g。
(5)由图3可知,在Fe极上镀Cu,则Fe为阴极,Cu为阳极,则与Cu相连的燃料电池的d极为正极,所以f处通入O2。燃料电池的c极为负极,e处通入C3H8O,C3H8O被氧化为![]() 。
。
【备注】本题以考生比较熟悉的肼为载体,两题均考查热化学和电化学综合知识,需要特别注意的是电极反应式书写时要考虑溶液的酸碱性环境。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】 [实验化学]
1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36 g·cm-3。实验室制备少量1-溴丙烷的主要步骤如下:
步骤1: 在仪器A中加入搅拌磁子、12 g正丙醇及20 mL水,冰水冷却下缓慢加入28 mL浓H2 SO4 ;冷却至室温,搅拌下加入24 g NaBr。
步骤2: 如图所示搭建实验装置, 缓慢加热,直到无油状物馏出为止。
步骤3: 将馏出液转入分液漏斗,分出有机相。
步骤4: 将分出的有机相转入分液漏斗,依次用12 mL H2O、12 mL 5% Na2CO3溶液和12 mL H2O洗涤,分液,得粗产品,进一步提纯得1-溴丙烷。

(1)仪器A的名称是_____________;加入搅拌磁子的目的是搅拌和___________________。
(2)反应时生成的主要有机副产物有2-溴丙烷和__________________________________。
(3)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是___________________。
(4)步骤2中需缓慢加热使反应和蒸馏平稳进行,目的是______________________________。
(4)步骤4中用5%Na2CO3溶液洗涤有机相的操作: 向分液漏斗中小心加入12 mL 5% Na2CO3溶液,振荡,____________,静置,分液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,前者属于电解质,后者属于非电解质的是( )
A.NaCl晶体、BaSO4 B.铝、二氧化碳
C.硫酸、蔗糖 D.熔融KNO3、氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 MnO2 和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水 CuCl2,装置如图所示。请回答下列问题:

(1)实验前检查整套装置的气密性的方法是______________,写出 A 中反应的化学方程式____________。
(2)B 中选用的试剂是____________,其作用是_____________;C 中选用的试剂是_____________,其作用是____________________。
(3)D 中反应的化学方程式是________________。
(4)装置 E 的目的是_______________,写出 E 中发生反应的化学方程式:______________。
(5)但实验发现 D 中得到的无水 CuCl2 总是偏蓝色,请你帮他们分析这是为什么?_________________,提出改进方案:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中,不正确的是
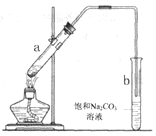
A. 试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象
B. 实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动
C. 试管b中饱和![]() 溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇
溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇
D. 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两种固态物质熔化或升华时,克服微粒间相互作用力属于同种类型的是( )
A.碘和氯化钾B.金刚石和蓝矾C.二氧化硅和干冰D.冰和冰醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家屠呦呦因开创性地运用萃取的原理从中草药中分离出青蒿素并应用于疟疾治疗获得今年的诺贝尔医学奖。萃取实验中用到的主要仪器是 ( )
A. 长颈漏斗 B. 分液漏斗
C. 圆底烧瓶 D. 蒸馏烧瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有下列各离子组的溶液中,能大量共存且溶液为无色透明的是()
A. Na+、Cu2+、Cl-、SO42― B. Ba2+、K+、OH-、NO3―
C. K+、Ca2+ 、NH4+、CO32― D. H+、Ca2+、Cl-、HCO3―
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com