随着环保意识的增强,清洁能源越来越受人们关注.
(1)氢能在二十一世纪有可能在世界能源舞台上成为一种举足轻重的二次能源.
①硫-碘循环分解水制氢主要涉及下列反应:
I.SO
2+2H
2O+I
2═H
2SO
4+2HI
Ⅱ.2HI?H
2+I
2Ⅲ.2H
2SO
4═2SO
2+O
2+2H
2O
分析上述反应,下列判断正确的是
(填序号,下同).
a.反应Ⅲ是一个吸热反应 b.在该循环过程中,有副产物硫酸生成
c.由反应Ⅱ可判断,HI不太稳定 d.循环过程中产生1 mol O
2的同时产生44.8L H
2②利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,已知该反应为:
Ⅰ.CH
4(g)+H
2O(g)?CO(g)+3H
2(g)△H=+206.2kJ/mol
Ⅱ.CH
4(g)+2H
2O(g)?CO
2(g)+4H
2(g)△H=+165.0kJ/mol
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去.工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO
2,同时又可制得等体积的氢气的方法.此反应称为一氧化碳变换反应,该反应的热化学方程式是
.
若800℃时,反应Ⅰ的平衡常数K
1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH
4)=2.0mol?L
-1;c(H
2O)=5.0mol?L
-1;c(CO)=2.0mol?L
-1;c(H
2)=2.5mol?L
-1,则此时正逆反应速率的关系是v
正
(填“>”、“<”或“=”)v
逆.
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H
2(g)?CH
3OH(g),分析该反应并回答下列问题:
①一定条件下,将CO与H
2以体积比1:1置于密闭容器中发生以上反应,能说明该反应已达到平衡的是
.
a.体系的压强不发生变化 b.CO与H
2的体积比保持不变
c.体系中碳元素的百分含量不再变化 d.单位时间内消耗1mol CO,同时生成1mol CH
3OH
②如图1是该反应在不同温度下CO的转化率随时间变化的曲线.T
1和T
2温度下的平衡常数大小关系是K
1
(填“>”、“<”或“=”) K
2.理由是:
.
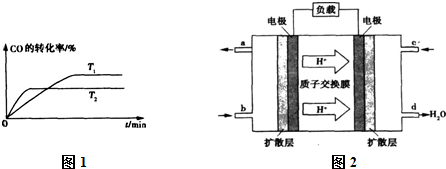
③已知甲醇燃料电池的工作原理如图2所示.
该电池工作时,该电池右边的电极发生的电极反应:
,工作一段时间后,当有3mol电子发生转移时,生成标准状况下的气体
L.





