
����Ŀ����������(��NOx��ʾ)�Ǵ�����Ⱦ����Ҫ���أ�����NOx����Դ�������ص㣬�ѿ��������ֻ�ѧ��������Ⱦ�ķ�����
��1������β���е�NO2�dz��д�����Ⱦ����Ҫ��Ⱦ��֮һ�����չ������£�NO2����һϵ�й⻯ѧ������ѭ����Ӧ���Ӷ����ϲ���O3�����ؿ�����Ⱦ����Ӧ����Ϊ��2NO2��2NO��2O����2NO��O2��2NO2����O��O2��O3�����й��ڸ÷�Ӧ���̼��������������ȷ����____(�����)��
A��NO2�������
B��NO�������
C��NO2ֻ����������
D��O3��O2��Ϊͬ��������
��2������β���е�CO������____��NO������____��
��3������β���е�CO��NOx���������¶��²��ô�ת����������ʹ�������Ӧ���ɲ������ѭ���������塣д��NO��CO��ԭ�Ļ�ѧ����ʽ��_____��
��4����ҵβ���е������ﳣ���ü�Һ���շ�������NO2���ռ���Һ����ʱ�������������Σ������ʵ���֮��Ϊ1��1���÷�Ӧ�����ӷ���ʽΪ____��1molNO2����ȫ����ʱ��ת�Ƶ��ӵ����ʵ���Ϊ____��NO��NO2�����ʵ���֮��1��1������NaOH��Һ��ȫ���պ�ֻ�õ�һ�����Σ������εĻ�ѧʽΪ____��
���𰸡�AD ���͵IJ���ȫȼ�� N2��O2�����������ڸ��»����µķ�Ӧ 2CO��2NO![]() N2��2CO2 2NO2��2OH-=NO3-��NO2-��H2O 0.5mol NaNO2
N2��2CO2 2NO2��2OH-=NO3-��NO2-��H2O 0.5mol NaNO2
��������
��1��A. �ɢ�+��+�ۿɵ��ܷ�Ӧ��3O2=2O3��˵������NO2������ã�NO�Ƿ�Ӧ�м��壻
��2������β���е�CO����������ȼ�ϵIJ���ȫȼ�գ�NO�����ڸ��£���ŵ磩�����¿����е�N2��O2��Ӧ��
��3��CO��NO����Ϊ�������ѭ����������CO2����������ԭΪN2�����ݵ�ʧ�����غ����ƽ����ʽ��
��4��NO2���ռ���Һ����ʱ�������������Σ������ʵ���֮��Ϊ1��1��˵��NO2�����绯��Ӧ���÷�Ӧ�����ӷ���ʽΪ: 2NO2��2OH-=NO3-��NO2-��H2O���Դ˽��
��1��A. �ɢ�+��+�ۿɵ��ܷ�Ӧ��3O2=2O3��˵������NO2������ã�NO�Ƿ�Ӧ�м��壬��A��ȷ��B��C����O3��O2��Ϊͬ�������壬��D��ȷ����ѡAD��
��2������β���е�CO����������ȼ�ϵIJ���ȫȼ�գ�NO�����ڸ��£���ŵ磩�����¿����е�N2��O2��Ӧ��
��3��CO��NO����Ϊ�������ѭ����������CO2����������ԭΪN2����ѧ����ʽ��2CO��2NO N2��2CO2��
N2��2CO2��
��4��NO2���ռ���Һ����ʱ�������������Σ������ʵ���֮��Ϊ1��1��˵��NO2�����绯��Ӧ���÷�Ӧ�����ӷ���ʽΪ: 2NO2��2OH-=NO3-��NO2-��H2O����Ӧ��2mol NO2��Ӧת��1mol���ӣ���1mol NO2����ȫ����ʱ��ת�Ƶ��ӵ����ʵ���Ϊ0.5mol�� NO��NO2���ʵ���֮��1��1�����Կ�����N2O3����NaOH��Һ��ȫ���պ�ֻ�õ��������Σ���ѧʽΪNaNO2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2A(g)��B(g) ![]() 2C(g)����H����a kJ/mol(a��0)����һ���д����Ĺ̶��ݻ��������м���2molA��1molB����500��ʱ��ַ�Ӧ��ƽ���C��Ũ��Ϊ��mol/L���ų�����Ϊb kJ��
2C(g)����H����a kJ/mol(a��0)����һ���д����Ĺ̶��ݻ��������м���2molA��1molB����500��ʱ��ַ�Ӧ��ƽ���C��Ũ��Ϊ��mol/L���ų�����Ϊb kJ��
(1)�Ƚ�a___b(����������������������)��
(2)�±�Ϊ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����ɴ˿���֪������T1____T2(�������� ��������������)��
T/K | T1 | T2 | T3 |
K | 1.00��107 | 2.45��105 | 1.88��103 |
����ԭ���������У�ֻ����2molC��500��ʱ��ַ�Ӧ��ƽ�����������Ϊc kJ��C��Ũ��___(������������������������)��mol/L��a��b��c֮��������ֹ�ϵ_______(�ô���ʽ��ʾ)��
(3)����ͬ������Ҫ��õ�2a kJ��������������ʵ����ʵ���������_____��
A��4molA��2molB B��4molA��2molB��2molC C��4molA��4molB D��6molA��4molB
(4)Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����____��
A����ʱ�����C���� B���ʵ������¶� C������B��Ũ�� D��ѡ���Ч����
(5)��������������Ϊ��ѹ����(��Ӧǰ�����ͬ)����ʼʱ����2molA��1molB��500��ʱ��ַ�Ӧ��ƽ��ų�����Ϊd kJ����d_____b(����������������������)��������_________��
(6)��һ���¶��£���һ���ݻ��ɱ�������У�����3molA��2molB�����������ʹ֮��Ӧ��2A(g)+B(g)![]() 2C(g)��ƽ��ʱ�������������ʵ���Ϊ��ʼʱ��90%������ͬһ��Ӧ�¶ȣ�����ͬ�����У�����ʼ���ʵ�����Ϊ4molA��3molB��2molC����ƽ��ʱA�İٷֺ���_____(���������������������С��������ȷ����)��
2C(g)��ƽ��ʱ�������������ʵ���Ϊ��ʼʱ��90%������ͬһ��Ӧ�¶ȣ�����ͬ�����У�����ʼ���ʵ�����Ϊ4molA��3molB��2molC����ƽ��ʱA�İٷֺ���_____(���������������������С��������ȷ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼Ԫ���γɵĵ��ʺͻ������ڻ��������ϡ�ҽѧ������Ӧ�ù㷺���ش��������⣺
(1)���ֽ��ʯ������̼��ɿ��Ŀ�ѧ����Ϊ___________����̬Cԭ�Ӻ���δ�ɶԵ��ӵ���ĿΪ_____________��
(2)������ṹΪ ��
��
�ٿ�������Cԭ�ӵ��ӻ���ʽΪ_________________��
��1 mol������������![]() ����ĿΪ_________________��
����ĿΪ_________________��
�ۿ�����ͨ����ˮ�е��ܽ�Ƚ�С����������![]() ����������ˮ���ܽ�ȵ�ԭ��Ϊ_________________��
����������ˮ���ܽ�ȵ�ԭ��Ϊ_________________��
��CH3+(��������)�����幹��Ϊ_________________��
(3)CO��NO��H2S��Ϊ������ϵ�����źŷ��ӡ�����H��C��O��S�ĵ縺���ɴ�С��˳��Ϊ____________��N��O��S�ĵ�һ�������ɴ�С��˳��Ϊ________________��
(4)�ɱ��������˹����ꡣ���۵���ڽ��ʯ��ԭ��Ϊ___________�����ɱ����ܶ�Ϊ1.56 g/cm3��������������Ϊ0.57 nm����ÿ������ʵ��ռ��CO2����ĿΪ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼװ���У����رջ�������Ʒ����Һ�ޱ仯��ʯ����Һ��죬����ʯ��ˮ����ǣ�����������Ʒ����Һ��ɫ��ʯ����Һ��죬����ʯ��ˮ����ǡ��ݴ��ж�������ƿ��ʢ�ŵ������ǣ� ��

A. ���������Ũ����
B. ���������̼��������Һ
C. ����������������Һ
D. ������̼������������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���������ܱ������м���2 mol A��0.6 mol C��һ������B�������塣һ�������·�����Ӧ��������Ũ����ʱ��仯��ͼһ��ʾ��ͼ��Ϊt2ʱ�̺�ı䷴Ӧ������ƽ����ϵ�з�Ӧ������ʱ��仯����������ĸ��ζ����ı�һ�ֲ�ͬ����������֪t3��t4��Ϊʹ�ô�����ͼһ��t0��t1��c(B)δ������

����˵������ȷ����
A.���¶��¸÷�Ӧ�Ļ�ѧ����ʽΪ2A(g)��B(s)![]() 3C(g)
3C(g)
B.t4��t5�θı������Ϊ��Сѹǿ
C.B����ʼ���ʵ���Ϊ1.0 mol
D.����ͬ�����£�����ʼʱ�����м���a mol A��b mol B��c mol C��Ҫ�ﵽt1ʱ��ͬ����ƽ�⣬a��b��cҪ���������Ϊa��2c/3=2.4��b��c/3=1.2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������Ҫ��������������������й㷺Ӧ�á����������ж����������γ��������Ҫ���塣������ʵ�����Ʊ����ǹ�ҵ��������������β�����ջ��������dz���Ҫ��
���������գ�
��1��ʵ���ҿ���ͭ��Ũ������Ȼ�������������Ʒ�Ӧ��ȡ��������
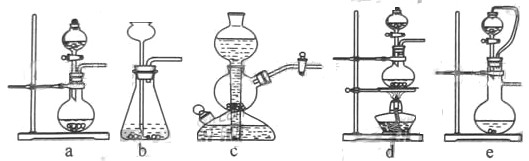
�����������������Ʒ�Ӧ��ȡ��������ϣ���ܿ��Ʒ�Ӧ�ٶȣ���ͼ�п�ѡ�õķ���װ��
��________����д��ĸ����
��2������������������Ʒ�Ӧ��ȡ3,36L����״������������������Ҫ��ȡ��������______g������һλС�������������4��0%�������ƣ��������������������������ƣ����������ȡ����������______g ������һλС������
��3��ʵ���Ҷ�������β�������빤ҵ��������Ļ�ѧԭ����ͨ��ʯ��-ʯ�෨�ͼ�dz��õ���������
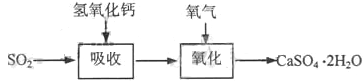
ʯ��-ʯ�෨�����շ�ӦΪSO2+Ca(OH)2��CaSO3��+H2O�����ղ�����������ɹܵ���������������������ӦΪ2CaSO3+O2+4H2O��2CaSO4��2H2O������������ͼ��
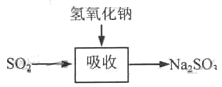
������շ�ӦΪSO2+2NaOH��Na2SO3+H2O������ص����������Ƽ���ǿ�����տ졢Ч�ʸߡ�����������ͼ��
��֪��
�Լ� | Ca(OH)2 | NaOH |
�۸�Ԫ/kg�� | 0.36 | 2.9 |
����SO2�ijɱ���Ԫ/mol�� | 0.027 | 0.232 |
ʯ��-ʯ�෨�ͼ���ն�������Ļ�ѧԭ����֮ͬ����____________________���ͼ��ȣ�ʯ��-ʯ�෨���ŵ���________________��ȱ����________________��
��4����ʯ��-ʯ�෨�ͼ�Ļ����ϣ����һ���Ľ��ġ���ʵ������ѭ��������������������ͼ��ʾ��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£������Ϊ3 L���ܱ������У�һ����̼��������Ӧ���ɼ״���
������ΪCu2O/ZnO����CO(g)��2H2(g)![]() CH3OH(g)���״������ʵ������¶ȵĹ�ϵ����ͼ��ʾ�����з�����ȷ���� �� ��
CH3OH(g)���״������ʵ������¶ȵĹ�ϵ����ͼ��ʾ�����з�����ȷ���� �� ��
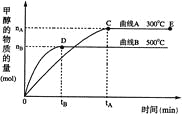
A. ��Ӧ�ﵽƽ��ʱ��ƽ�ⳣ������ʽ K��c(CH3OH)/c(CO)��c2(H2)
B. �����¶ȣ�Kֵ����
C. ��500�����ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)��3tB/2nBmol��(L��min)��1
D. �����������䣬E������ѹ����ԭ����1/2������ƽ��ʱn(H2)/n(CH3OH)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ױƷ�����Z��������Ч��ԭ������������ȡ���ֿ������·�Ӧ�Ʊ��������й�������ȷ���ǣ� ��
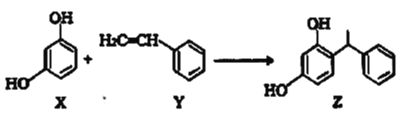
A.Z�ķ���ʽΪ![]()
B.X��Y����������ԭ�Ӷ����ܴ���ͬһƽ��
C.Y�ı����϶�����ﹲ��10��
D.X��Y��Z����ʹ��ˮ��ɫ����ɫԭ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Կ��淴Ӧ4NH3(g)��5O2(g) ![]() 4NO(g)��6H2O(g)������������ȷ����(����)
4NO(g)��6H2O(g)������������ȷ����(����)
A. �ﵽ��ѧƽ��ʱ4v��(O2)��5v��(NO)
B. ����λʱ��������x mol NO��ͬʱ������x mol NH3����Ӧ�ﵽƽ��״̬
C. �ﵽ��ѧƽ��ʱ�������������ݻ���������Ӧ���ʼ�С���淴Ӧ��������
D. ��ѧ��Ӧ���ʹ�ϵ��2v��(NH3)��3v��(H2O)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com