
【题目】I现有下列七种物质:①铝 ②蔗糖 ③CO2 ④H2SO4 ⑤Ba(OH)2 ⑥红褐色的氢氧化铁胶体 ⑦HCl.
(1)上述物质中属于电解质的有__________(填序号)。
(2)向⑥的溶液中逐渐滴加⑦的溶液,看到的现象是________________________。
(3)上述物质中有两种物质在水溶液中发生反应,其离子方程式为:H++OH﹣═H2O,则该反应的化学方程式为______________________________。
(4)⑦的浓溶液与高锰酸钾发生反应的化学方程式为:2KMnO4+16HCl(浓)═2MnCl2+2KCl+5Cl2↑+8H2O。
①该反应中的氧化剂是________,氧化产物是_________。
②浓盐酸在反应中显示出来的性质是____________。
③产生0.1mol Cl2,被氧化的的浓盐酸的物质的量为_______mol。
II(1)写出铁与水蒸气在高温下反应方程式___________________________。
(2)常温下,铜在潮湿的空气里会被锈蚀,有关化学方程式为_________________________________。
(3)在呼吸面具中,Na2O2 与CO2反应的化学方程式为____________________________________。当有7.8克Na2O2反应时,放出氧气的质量为____________。
(4)将铜片投到FeCl3溶液中,发生的反应离子方程式为__________________________。
(5)向FeSO4溶液中滴加NaOH溶液时,生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色。写出此变化过程的化学方程式:_________________________________。
【答案】④⑤⑦ 开始产生红褐色沉淀,后来沉淀溶解消失 Ba(OH)2+2HCl=BaCl2+2H2O KMnO4 Cl2 还原性和酸性 0.2 3Fe + 4H2O(g)![]() Fe3O4 + 4H2 2Cu + O2 +CO2 + H2O =Cu2(OH)2CO3 2Na2O2 + 2CO2 == 2Na2CO3 + O2 1.6g 2Fe3+ + Cu = 2Fe2+ + Cu2+ FeSO4 + 2NaOH = Fe(OH)2 ↓+ Na2SO4, 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Fe3O4 + 4H2 2Cu + O2 +CO2 + H2O =Cu2(OH)2CO3 2Na2O2 + 2CO2 == 2Na2CO3 + O2 1.6g 2Fe3+ + Cu = 2Fe2+ + Cu2+ FeSO4 + 2NaOH = Fe(OH)2 ↓+ Na2SO4, 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
【解析】
I.(1)电解质:在水溶液中或熔融状态下能够导电的化合物;非电解质:在熔融状态和水溶液中都不能导电的化合物;(2)氢氧化铁胶体中加电解质会发生聚沉,氢氧化铁能与强酸反应;(3)强酸与强碱反应生成可溶性盐的离子方程为:H++OH-═H2O;(4)氧化剂反应中得到电子,化合价降低,还原剂化合价升高被氧化,产物为氧化产物,据此分析解答;
II.(1)铁与水蒸气在高温下反应生成四氧化三铁和氢气;(2)常温下,铜在潮湿的空气里会被锈蚀生成碱式碳酸铜;(3)在呼吸面具中,Na2O2 与CO2反应生成碳酸钠和氧气;(4)将铜片投到FeCl3溶液中,铜被氯化铁氧化生成氯化铜;(5)向FeSO4溶液中滴加NaOH溶液时,生成的白色絮状沉淀(氢氧化亚铁)迅速变成灰绿色,最后变成红褐色(氢氧化铁),据此书写反应的方程式。
I.(1)①铝为金属单质,既不是电解质也不是非电解质;②蔗糖在熔融状态和水溶液中都不能导电,是非电解质;③CO2自身不能电离,是非电解质;④H2SO4在水溶液中能够导电,是电解质;⑤Ba(OH)2在水溶液中能够导电,是电解质;⑥红褐色的氢氧化铁胶体是混合物,既不是电解质也不是非电解质;⑦HCl在水溶液中能够导电,是电解质;故属于电解质的是:④⑤⑦,故答案为:④⑤⑦;
(2)向氢氧化铁胶体中加入盐酸,胶体遇到电解质会发生聚沉,故先出现红褐色沉淀,氢氧化铁能与盐酸反应,后沉淀溶解,故答案为:开始产生红褐色沉淀,后来沉淀溶解消失;
(3)离子反应H++OH-=H2O代表强酸和强碱反应生成可溶性的盐和水的反应,如Ba(OH)2+2HCl═BaCl2+2H2O等,故答案为:Ba(OH)2+2HCl═BaCl2+2H2O;
(4)①浓盐酸与高锰酸钾发生反应的化学方程式为:2KMnO4+16HCl(浓)═2MnCl2+2KCl+5Cl2↑+8H2O,反应中KMnO4中锰的化合价由+7价降低为+2价,化合价降低,故KMnO4为氧化剂;HCl中氯的化合价部分升高,被氧化,生成的氯气是氧化产物,故答案为:KMnO4;Cl2;
②根据方程式,氯化氢中氯元素的化合价部分升高,氯化氢为还原剂,部分化合价不变,是酸,在反应中显示出来的性质有还原性和酸性,故答案为:还原性和酸性;
③根据方程式,生成5mol氯气,有16mol氯化氢参与反应,其中10mol氯化氢被氧化,因此产生0.1mol Cl2,被氧化的的浓盐酸的物质的量为0.2mol,故答案为:0.2;
II.(1)铁与水蒸气在高温下反应生成四氧化三铁和氢气,反应的方程式为3Fe + 4H2O(g)![]() Fe3O4 + 4H2,故答案为:3Fe + 4H2O(g)
Fe3O4 + 4H2,故答案为:3Fe + 4H2O(g)![]() Fe3O4 + 4H2;
Fe3O4 + 4H2;
(2)常温下,铜在潮湿的空气里会被锈蚀生成碱式碳酸铜,反应的方程式为2Cu + O2 +CO2 + H2O =Cu2(OH)2CO3,故答案为:2Cu + O2 +CO2 + H2O =Cu2(OH)2CO3;
(3)在呼吸面具中,Na2O2 与CO2反应的化学方程式为2Na2O2 + 2CO2 = 2Na2CO3 + O2;7.8克Na2O2的物质的量为0.1mol,根据方程式,放出氧气0.05mol,氧气的质量为0.05mol×32g/mol=1.6g,故答案为:2Na2O2 + 2CO2 = 2Na2CO3 + O2;1.6g;
(4)将铜片投到FeCl3溶液中,铜被氯化铁氧化生成氯化铜,反应的离子方程式为2Fe3+ + Cu = 2Fe2+ + Cu2+,故答案为:2Fe3+ + Cu = 2Fe2+ + Cu2+;
(5)向FeSO4溶液中滴加NaOH溶液时,生成的白色絮状沉淀为氢氧化亚铁,迅速变成灰绿色,最后变成红褐色,是随后发生了氢氧化亚铁被氧化生成了氢氧化铁,变化过程中的化学方程式有FeSO4 + 2NaOH = Fe(OH)2 ↓+ Na2SO4、4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3,故答案为:FeSO4 + 2NaOH = Fe(OH)2 ↓+ Na2SO4、4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3。


 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】化学无处不在,下列有关化学与生活、生产和技术的说法中,不正确的是( )
A.医疗上常用75%的酒精进行消毒
B.光导纤维的主要成份是二氧化硅
C.食品行业用小苏打制作发酵粉
D.SO2可以随意排放,对环境没有污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分离和提纯的方法中正确的是( )
A.除去Cl2的HCl气体可以通过浓硫酸
B.碳酸钠固体中的碳酸氢钠杂质可以通过加热除去
C.SO2可以通过碱石灰干燥
D.FeCl3溶液中含有CuCl2可以加入足量NaOH溶液除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W有如图所示的转化关系(反应条件和部分其它反应物省略),则X、Y、Z可能是( )

①Na、Na2O、Na2O2 ②AlCl3、Al(OH)3、NaAlO2 ③Fe、FeCl2、FeCl3 ④NaOH、Na2CO3、NaHCO3 ⑤C、CO、CO2
A. ①②③④⑤ B. ②④ C. ①③⑤ D. ①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、硫、氮的化合物在工业上用途非常广泛。
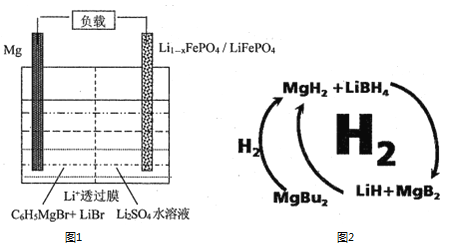
(1)一种镁—锂双离子二次电池的装置如图1所示。
①放电时,Mg电极为_____(填“正极”或“负极”)。
②充电时,Li+迁移至_____________(填“阳极区”或“阴极区”)。
(2)纳米MgH2和LiBH4组成的体系如图2所示,400℃以上受热放氢时发生反应的化学方程式为_____________________________________________。
(3)硝酸厂尾气中含有大量的NO,可用氢气催化还原法除去NO,发生的主要反应如下:
2NO(g)+4H2(g)+O2(g)==N2(g)+4H2O(g) △H =-1143kJ·mol-1
2H2(g)+ O2(g)==2H2O(g) △H =-484kJ·mol-1
则2NO(g)+2H2(g)==N2(g)+2H2O(g) △H =____kJ·mol-1
(4)在一定条件下,反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图3所示。
2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图3所示。
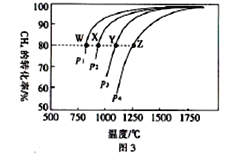
①图中p1、p2、p3、p4代表不同压强,压强最大的是_______。该反应的△H___(填“>”“<”“=”下同)0。
②压强为p4时,在Y点:v(正)__________v(逆)。
③图中W、X、Y、Z四点对应的反应的平衡常数K1、K2、K3、K4由大到小的顺序为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2SO2(g)+O2(g)![]() 2SO3(g) △H=-196kJ·mol-1。现在一容积为2L的密闭容器中充入2molSO2、1molO2,加入固体催化剂,保持温度在450℃使之发生反应,5min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
2SO3(g) △H=-196kJ·mol-1。现在一容积为2L的密闭容器中充入2molSO2、1molO2,加入固体催化剂,保持温度在450℃使之发生反应,5min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
A. SO2的转化率为30%
B. 反应共放出了196.6kJ的热量
C. 用SO2表示的5min内的平均反应速率为0.36mol·L-1·min-1
D. 平衡时SO3的浓度是0.9mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、Fe3O4、Fe2O3、FeO的混合物中加入200 mL 1 mol·L-1的盐酸,恰好使混合物完全反应溶解,放出4.48 mL(标准状况)气体。所得溶液中,加入KSCN溶液无红色出现,那么用足量的CO在高温下还原相同质量的此混合物,得到铁的质量为
A. 11.2 g B. 5.6 g C. 2.8 g D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用无机矿物资源生产部分材料的流程示意图如下。下列说法不正确的是( )

A. 在铝土矿制备较高纯度Al的过程中常用到NaOH溶液、CO2气体、冰晶石
B. 石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应
C. 在制粗硅时,被氧化的物质与被还原的物质的物质的量之比为2∶1
D. 黄铜矿(CuFeS2)与O2反应产生的Cu2S、FeO均是还原产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com