
【题目】工业上利用无机矿物资源生产部分材料的流程示意图如下。下列说法不正确的是( )

A. 在铝土矿制备较高纯度Al的过程中常用到NaOH溶液、CO2气体、冰晶石
B. 石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应
C. 在制粗硅时,被氧化的物质与被还原的物质的物质的量之比为2∶1
D. 黄铜矿(CuFeS2)与O2反应产生的Cu2S、FeO均是还原产物
【答案】D
【解析】A. 用铝土矿制备较高纯度A1,首先用NaOH溶液将铝土矿中的氧化铝溶解转化为偏铝酸钠溶液,然后过滤、向滤液中通入CO2气体把偏铝酸钠转化为氢氧化铝沉淀,再过滤得氢氧化铝,接着加热氢氧化铝让其分解为氧化铝,最后用冰晶石作助熔剂,电解熔融的氧化铝得到铝,所以A正确;B.、石英的主要成分是二氧化硅,它属于酸性氧化物不与盐酸反应。玻璃的主要成分有二氧化硅、硅酸钠、硅酸钙,组成中有盐故被称为硅酸盐产品,它也不能与盐酸反应,实验室经常用玻璃瓶盛放盐酸,所以B不正确;C. 在制粗硅时,发生反应SiO2+2C=Si+2CO,被氧化的物质C与被还原的物质SiO2的物质的量之比为2∶1,C是正确的;D. 黄铜矿(CuFeS2)与O2反应,铜由+2价降为+1价被还原得到Cu2S、氧由0价降至-2得到FeO,所以Cu2S、FeO均是还原产物,D正确。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】I现有下列七种物质:①铝 ②蔗糖 ③CO2 ④H2SO4 ⑤Ba(OH)2 ⑥红褐色的氢氧化铁胶体 ⑦HCl.
(1)上述物质中属于电解质的有__________(填序号)。
(2)向⑥的溶液中逐渐滴加⑦的溶液,看到的现象是________________________。
(3)上述物质中有两种物质在水溶液中发生反应,其离子方程式为:H++OH﹣═H2O,则该反应的化学方程式为______________________________。
(4)⑦的浓溶液与高锰酸钾发生反应的化学方程式为:2KMnO4+16HCl(浓)═2MnCl2+2KCl+5Cl2↑+8H2O。
①该反应中的氧化剂是________,氧化产物是_________。
②浓盐酸在反应中显示出来的性质是____________。
③产生0.1mol Cl2,被氧化的的浓盐酸的物质的量为_______mol。
II(1)写出铁与水蒸气在高温下反应方程式___________________________。
(2)常温下,铜在潮湿的空气里会被锈蚀,有关化学方程式为_________________________________。
(3)在呼吸面具中,Na2O2 与CO2反应的化学方程式为____________________________________。当有7.8克Na2O2反应时,放出氧气的质量为____________。
(4)将铜片投到FeCl3溶液中,发生的反应离子方程式为__________________________。
(5)向FeSO4溶液中滴加NaOH溶液时,生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色。写出此变化过程的化学方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO2与N2O4可相互转化:2NO2(g)![]() N2O4(g) △H=-57.2kJ/mol,将一定量NO2和N2O4的混合气体充入2L的恒温密闭容器中,各组分物质的量浓度随时间变化的关系如下图所示。下列推理分析不合理的是
N2O4(g) △H=-57.2kJ/mol,将一定量NO2和N2O4的混合气体充入2L的恒温密闭容器中,各组分物质的量浓度随时间变化的关系如下图所示。下列推理分析不合理的是

A. 前10min内,用v(NO2)表示的化学反应速率为0.04mol·L-1·min-1
B. 反应进行到10min时,反应物的转化率约为33.3%
C. a点正反应速率小于逆反应速率
D. 25min时,改变的条件是增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按如图所示操作,充分反应后:
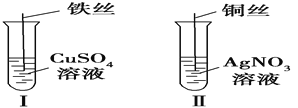
①Ⅰ中发生反应的离子方程式为___________________________________;
②Ⅱ中铜丝上观察到的现象是______________________________________
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为__________。
(2)将少量Cl2通入FeCl2的溶液中,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-,这个事实说明具有还原性的粒子还原性强弱为___________________
(3) NaHCO3溶液与足量澄清石灰水反应的离子方程式_____________________________
(4)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。
①写出反应方程式并标出电子转移方向及数目______________________________________
②若反应方程式中转移了0.3 mol电子,则氧化产物的质量是______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列叙述正确的是
A. 将1 mL pH=3的一元酸溶液稀释到10 mL,若溶液pH<4,则此酸为弱酸
B. 将1 mL ![]() mol/L盐酸稀释到1000mL,得到pH=8的盐酸
mol/L盐酸稀释到1000mL,得到pH=8的盐酸
C. 用pH=1的盐酸分别中和相同体积的pH=13 NaOH溶液和氨水,NaOH消耗盐酸的体积大
D. pH=2的盐酸与pH=1的硫酸比较, ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )

A. 正极反应式为![]()
B. 微生物所在电极区放电时发生还原反应
C. 放电过程中,H+从正极区移向负极区
D. 若用该电池给铅蓄电池充电,MnO2电极质量减少8.7g,则铅蓄电池负极增重9.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年3月21日是第二十五届“世界水日”,保护水资源,合理利用废水节省水资源,加强废水的回收利用已被越来越多的人所关注。已知:某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品1L,进行了三组实验,其操作和有关图像如下所示:

请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的阴离子是__________,一定存在的阳离子是___________。
(2)写出实验③图像中沉淀达到最大量且质量不再发生变化阶段发生反应的离子反应方程式:________。
(3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为______,所得沉淀的最大质量是______g。
(4)若通过实验确定原废水中c(Na+)=0.18 mol·L-1,试判断原废水中NO3-是否存在?____(填“存在”“不存在”或“不确定”)。若存在, c(NO3-) = _____ mol·L-1。(若不存在或不确定则此空不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为___________(用名称表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式:___________________。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是______________。
① 硫酸铝和氢氧化钠 ② 硫酸锌和氢氧化钠 ③硫酸铝和氨水 ④ 硫酸锌和氨水
(4)在火箭和导弹技术中,将铝粉与石墨、TiO2按一定比例混合均匀,涂在金属表面,在高温下煅烧,金属表面生成TiC和另一种耐高温的物质,写出该反应的化学方程式:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com