
ЎҫМвДҝЎҝДіПгБПFөДәПіЙВ·ҫ¶ИзНјЛщКҫ![]() Іҝ·ЦІъОпВФИҘ
Іҝ·ЦІъОпВФИҘ![]() ЎЈ
ЎЈ

ТСЦӘЈәўЩН¬Т»ёцМјФӯЧУЙПБ¬ҪУУРБҪёцфЗ»щКұІ»ОИ¶ЁЈ¬»бЧФ¶ҜНСЛ®
ўЪ![]()
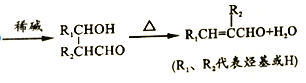
Зл»ШҙрПВБРОКМвЈә
![]()
![]() өДПөНіГьГыОӘ______Ј»AөДҪб№№јтКҪОӘ___________ЎЈ
өДПөНіГьГыОӘ______Ј»AөДҪб№№јтКҪОӘ___________ЎЈ
![]() ә¬УРөД№ЩДЬНЕГыіЖКЗ ______________ЎЈ
ә¬УРөД№ЩДЬНЕГыіЖКЗ ______________ЎЈ
![]() РҙіцІҪЦиIIIөЪўЩІҪ·ҙУҰөД»ҜС§·ҪіМКҪ_____________Ј»·ҙУҰўтөД·ҙУҰАаРНОӘ_____ЎЈ
РҙіцІҪЦиIIIөЪўЩІҪ·ҙУҰөД»ҜС§·ҪіМКҪ_____________Ј»·ҙУҰўтөД·ҙУҰАаРНОӘ_____ЎЈ
![]() ФЪТэ·ўјБЧчУГПВЈ¬DҝЙТФЛхҫЫәПіЙёЯҫЫОпЈ¬Жд»ҜС§·ҪіМКҪ____________________ЎЈ
ФЪТэ·ўјБЧчУГПВЈ¬DҝЙТФЛхҫЫәПіЙёЯҫЫОпЈ¬Жд»ҜС§·ҪіМКҪ____________________ЎЈ
![]() ОпЦКGөД»ҜС§КҪОӘ
ОпЦКGөД»ҜС§КҪОӘ![]() Ј¬Н¬КұВъЧгПВБРМхјюөДGөДН¬·ЦТм№№МеУР_____
Ј¬Н¬КұВъЧгПВБРМхјюөДGөДН¬·ЦТм№№МеУР_____![]() РҙҪб№№јтКҪ
РҙҪб№№јтКҪ![]() ЎЈ
ЎЈ
ўЩәЛҙЕ№ІХсЗвЖЧПФКҫұҪ»·ЙПУРЛДЦЦІ»Н¬өДЗв
ўЪіЈОВПВЈ¬ДЬУл![]() ИЬТә·ҙУҰІъЙъЖшМе
ИЬТә·ҙУҰІъЙъЖшМе
ўЫУцВИ»ҜМъИЬТә»бПФЙ«
![]() ҪбәПЙПКцәПіЙ·Ҫ·ЁЈ¬ТФТТҙјОӘФӯБПЈ¬ОЮ»ъКФјБИОСЎЈ¬ЙијЖәПіЙҫЫ
ҪбәПЙПКцәПіЙ·Ҫ·ЁЈ¬ТФТТҙјОӘФӯБПЈ¬ОЮ»ъКФјБИОСЎЈ¬ЙијЖәПіЙҫЫ![]() ¶ЎП©И©
¶ЎП©И©![]() өДПЯВ·НјЈә__________________________________________________ЎЈәПіЙВ·ПЯКҫАэИзПВЈәCH2=CH2
өДПЯВ·НјЈә__________________________________________________ЎЈәПіЙВ·ПЯКҫАэИзПВЈәCH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
Ўҫҙр°ёЎҝ![]() јЧ»щұыИ©
јЧ»щұыИ© ![]() И©»щЎўфЗ»щ
И©»щЎўфЗ»щ 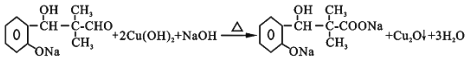 јУіЙ·ҙУҰ
јУіЙ·ҙУҰ 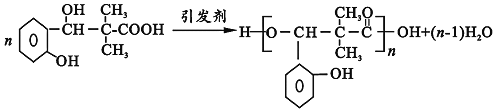
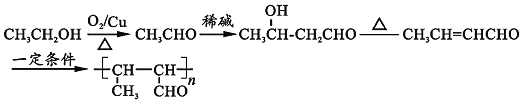
ЎҫҪвОцЎҝ
ҪбәПFөДҪб№№јтКҪҝЙЦӘЈ¬BУл![]() ·ўЙъРЕПў
·ўЙъРЕПў![]() ЦРөД·ҙУҰёДұдМјБҙЈ¬BУҰОӘИ©Ј¬
ЦРөД·ҙУҰёДұдМјБҙЈ¬BУҰОӘИ©Ј¬![]() УлВИЖшФЪ№вХХМхјюПВ·ўЙъјЧ»щЙПөДИЎҙъ·ҙУҰЈ¬AјоРФЛ®ҪвЎўЛб»ҜөГөҪBЈ¬ҪбәПРЕПў
УлВИЖшФЪ№вХХМхјюПВ·ўЙъјЧ»щЙПөДИЎҙъ·ҙУҰЈ¬AјоРФЛ®ҪвЎўЛб»ҜөГөҪBЈ¬ҪбәПРЕПў![]() Ј¬ҝЙЦӘAОӘ
Ј¬ҝЙЦӘAОӘ![]() Ј¬BОӘ
Ј¬BОӘ![]() ЎЈBУл
ЎЈBУл![]() ·ўЙъРЕПў
·ўЙъРЕПў![]() ЦРөДөЪТ»ІҪјУіЙ·ҙУҰЈ¬Н¬Кұ·УфЗ»щУлЗвСх»ҜДЖ·ўЙъЦРәН·ҙУҰЈ¬№КCОӘ
ЦРөДөЪТ»ІҪјУіЙ·ҙУҰЈ¬Н¬Кұ·УфЗ»щУлЗвСх»ҜДЖ·ўЙъЦРәН·ҙУҰЈ¬№КCОӘ Ј¬C·ўЙъСх»Ҝ·ҙУҰЎўЛб»ҜөГөҪDОӘ
Ј¬C·ўЙъСх»Ҝ·ҙУҰЎўЛб»ҜөГөҪDОӘ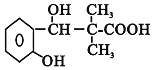 Ј¬ҪбәПFөДҪб№№јтКҪҝЙЦӘEОӘ
Ј¬ҪбәПFөДҪб№№јтКҪҝЙЦӘEОӘ![]() ЎЈ
ЎЈ
ЈЁ1Ј©![]() өДПөНіГьГыОӘ
өДПөНіГьГыОӘ![]() јЧ»щұыИ©Ј¬AөДҪб№№јтКҪОӘ
јЧ»щұыИ©Ј¬AөДҪб№№јтКҪОӘ![]() Ј¬№Кҙр°ёОӘЈә
Ј¬№Кҙр°ёОӘЈә![]() јЧ»щұыИ©Ј»
јЧ»щұыИ©Ј»![]() Ј»
Ј»
ЈЁ2Ј©BөДҪб№№јтКҪОӘ![]() Ј¬№ЩДЬНЕОӘИ©»щЎўфЗ»щЈ¬№Кҙр°ёОӘЈәИ©»щЎўфЗ»щЈ»
Ј¬№ЩДЬНЕОӘИ©»щЎўфЗ»щЈ¬№Кҙр°ёОӘЈәИ©»щЎўфЗ»щЈ»
ЈЁ3Ј©ІҪЦиIIIөЪ![]() ІҪ·ҙУҰОӘ
ІҪ·ҙУҰОӘ УлРВЦЖөДЗвСх»ҜНӯ№ІИИ·ўЙъСх»Ҝ·ҙУҰЈ¬·ҙУҰөД»ҜС§·ҪіМКҪЈә
УлРВЦЖөДЗвСх»ҜНӯ№ІИИ·ўЙъСх»Ҝ·ҙУҰЈ¬·ҙУҰөД»ҜС§·ҪіМКҪЈә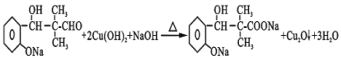 Ј»·ҙУҰўтОӘ
Ј»·ҙУҰўтОӘ![]() Ул
Ул![]() ФЪЗвСх»ҜДЖИЬТәЦР·ўЙъјУіЙ·ҙУҰЙъіЙ
ФЪЗвСх»ҜДЖИЬТәЦР·ўЙъјУіЙ·ҙУҰЙъіЙ Ј¬№Кҙр°ёОӘЈә
Ј¬№Кҙр°ёОӘЈә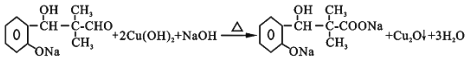 Ј»јУіЙ·ҙУҰЈ»
Ј»јУіЙ·ҙУҰЈ»
ЈЁ4Ј©ФЪТэ·ўјБЧчУГПВЈ¬DЦРфИ»щУлфЗ»щҝЙТФ·ўЙъЛхҫЫ·ҙУҰЙъіЙёЯҫЫхҘ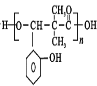 Ј¬·ҙУҰөД»ҜС§·ҪіМКҪЈә
Ј¬·ҙУҰөД»ҜС§·ҪіМКҪЈә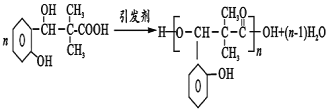 Ј¬№Кҙр°ёОӘЈә
Ј¬№Кҙр°ёОӘЈә Ј»
Ј»
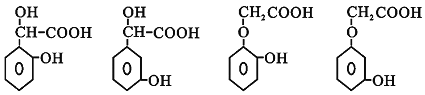
ЈЁ5Ј©ОпЦКGөД»ҜС§КҪОӘ![]() Ј¬GөДН¬·ЦТм№№МеН¬КұВъЧгПВБРМхјюЈә
Ј¬GөДН¬·ЦТм№№МеН¬КұВъЧгПВБРМхјюЈә![]() әЛҙЕ№ІХсЗвЖЧПФКҫұҪ»·ЙПУРЛДЦЦІ»Н¬өДЗвЈ¬ЛөГчұҪ»·ЙПУРёцІ»Н¬өДИЎҙъ»щЈ¬ЗТҙҰУЪјдО»»тБЪО»Ј¬
әЛҙЕ№ІХсЗвЖЧПФКҫұҪ»·ЙПУРЛДЦЦІ»Н¬өДЗвЈ¬ЛөГчұҪ»·ЙПУРёцІ»Н¬өДИЎҙъ»щЈ¬ЗТҙҰУЪјдО»»тБЪО»Ј¬![]() іЈОВПВЈ¬ДЬУл
іЈОВПВЈ¬ДЬУл![]() ИЬТә·ҙУҰІъЙъЖшМеЈ¬ЛөГчә¬УР
ИЬТә·ҙУҰІъЙъЖшМеЈ¬ЛөГчә¬УР![]() Ј¬
Ј¬![]() УцВИ»ҜМъИЬТә»бПФЙ«Ј¬ЛөГчә¬УР·УфЗ»щЈ¬ҪбәП·ЦЧУКҪҝЙЦӘЈ¬ЖдЦРТ»ёцИЎҙъ»щОӘ
УцВИ»ҜМъИЬТә»бПФЙ«Ј¬ЛөГчә¬УР·УфЗ»щЈ¬ҪбәП·ЦЧУКҪҝЙЦӘЈ¬ЖдЦРТ»ёцИЎҙъ»щОӘ![]() Ј¬БнНвТ»ёцИЎҙъ»щОӘ
Ј¬БнНвТ»ёцИЎҙъ»щОӘ![]() »тОӘ
»тОӘ![]() Ј¬·ыәПМхјюөДН¬·ЦТм№№МеҪб№№јтКҪОӘ
Ј¬·ыәПМхјюөДН¬·ЦТм№№МеҪб№№јтКҪОӘ Ј¬№Кҙр°ёОӘЈә
Ј¬№Кҙр°ёОӘЈә Ј»
Ј»
ЈЁ6Ј©РиТӘПИЦЖұё![]() Ј¬ҪбәПРЕПў
Ј¬ҪбәПРЕПў![]() ҝЙЦӘЈ¬2·ЦЧУ
ҝЙЦӘЈ¬2·ЦЧУ![]() ФЪПЎјоМхјюПВ·ҙУҰЈ¬ФЩјУИИҝЙТФөГөҪ
ФЪПЎјоМхјюПВ·ҙУҰЈ¬ФЩјУИИҝЙТФөГөҪ![]() Ј¬ТТҙјҙЯ»ҜСх»ҜөГөҪТТИ©Ј¬әПіЙВ·ПЯБчіМНјОӘЈә
Ј¬ТТҙјҙЯ»ҜСх»ҜөГөҪТТИ©Ј¬әПіЙВ·ПЯБчіМНјОӘЈә![]() Ј¬№Кҙр°ёОӘЈә
Ј¬№Кҙр°ёОӘЈә![]() ЎЈ
ЎЈ



| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВГжКЗјёЦЦУР»ъ»ҜәПОпөДЧӘ»»№ШПөЈә
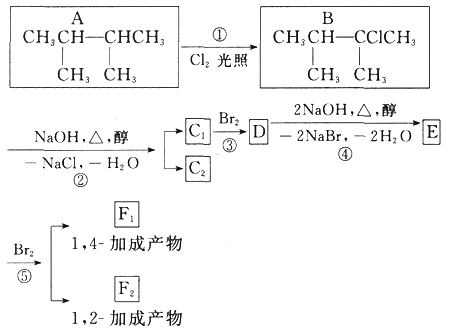
Зл»ШҙрПВБРОКМвЈә
ЈЁ1Ј©ёщҫЭПөНіГьГы·ЁЈ¬»ҜәПОпAөДГыіЖКЗ_____ЎЈ
ЈЁ2Ј©ЙПНј·ҙУҰЦРЈЁМо·ҙУҰАаРНЈ©Ј¬ўЩКЗ_____·ҙУҰЈ¬ўЫКЗ_____·ҙУҰЎЈ
ЈЁ3Ј©EКЗЦШТӘөД»Ҝ№ӨФӯБПЈ¬РҙіцУЙDЙъіЙEөД»ҜС§·ҪіМКҪЈә_____ЎЈ
ЈЁ4Ј©C1өДҪб№№јтКҪКЗ_____ЎЈ
ЈЁ5Ј©Рҙіц·ыәППВБРМхјюөДAөДН¬·ЦТм№№МеөДҪб№№јтКҪ_____ЎЈ
ўЩә¬Ц§Бҙ ўЪәЛҙЕ№ІХсЗвЖЧУР3ёц·е
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТСЦӘІв¶ЁЦРәНИИөДКөСйІҪЦиИзПВЈә
![]() БҝИЎ50mL
БҝИЎ50mL![]() БтЛбө№ИлРЎЙХұӯЦРЈ¬ІвБҝОВ¶ИЈ»
БтЛбө№ИлРЎЙХұӯЦРЈ¬ІвБҝОВ¶ИЈ»
![]() БҝИЎ50mL
БҝИЎ50mL![]() NaOHИЬТәЈ¬ІвБҝОВ¶ИЈ»
NaOHИЬТәЈ¬ІвБҝОВ¶ИЈ»
![]() Ҫ«NaOHИЬТәө№ИлРЎЙХұӯЦРЈ¬»мәПҫщФИәуІвБҝ»мәПТәОВ¶ИЈ®
Ҫ«NaOHИЬТәө№ИлРЎЙХұӯЦРЈ¬»мәПҫщФИәуІвБҝ»мәПТәОВ¶ИЈ®
Зл»ШҙрЈә
ЈЁ1Ј©![]() ИЬТәЙФ№эБҝөДФӯТт______Ј®
ИЬТәЙФ№эБҝөДФӯТт______Ј®
ЈЁ2Ј©јУИлNaOHИЬТәөДХэИ·ІЩЧчКЗ______![]() МоЧЦДё
МоЧЦДё![]() Ј®
Ј®
A.СШІЈБ§°ф»әВэјУИл![]() Т»ҙОСёЛЩјУИл
Т»ҙОСёЛЩјУИл![]() ·ЦИэҙОјУИл
·ЦИэҙОјУИл
ЈЁ3Ј©К№БтЛбУлNaOHИЬТә»мәПҫщФИөДХэИ·ІЩЧчКЗ______Ј®
ОВ¶И КөСйҙОКэ | ЖрКјОВ¶И | ЦХЦ№ОВ¶И
| ОВ¶ИІоЖҪҫщЦө
| ||
| NaOH | ЖҪҫщЦө | |||
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
ЈЁ4Ј©ЙиИЬТәөДГЬ¶ИҫщОӘ![]() Ј¬ЦРәНәуИЬТәөДұИИИИЭ
Ј¬ЦРәНәуИЬТәөДұИИИИЭ![]() Ј¬ЗлёщҫЭКөСйКэҫЭЗуіцЦРәНИИОӘ______РҙіцёГ·ҙУҰөДИИ»ҜС§·ҪіМКҪ______
Ј¬ЗлёщҫЭКөСйКэҫЭЗуіцЦРәНИИОӘ______РҙіцёГ·ҙУҰөДИИ»ҜС§·ҪіМКҪ______
ЈЁ5Ј©ИфҪ«ә¬![]()
![]() өДЕЁБтЛбУлә¬1molNaOHөДИЬТә»мәПЈ¬·ЕіцөДИИБҝ______
өДЕЁБтЛбУлә¬1molNaOHөДИЬТә»мәПЈ¬·ЕіцөДИИБҝ______![]() МоЎ°РЎУЪЎұЎўЎ°өИУЪЎұ»тЎ°ҙуУЪЎұ
МоЎ°РЎУЪЎұЎўЎ°өИУЪЎұ»тЎ°ҙуУЪЎұ![]() Ј¬ФӯТтКЗ______Ј®
Ј¬ФӯТтКЗ______Ј®
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ№ӨТөЙъІъБтЛбҪУҙҘКТ·ўЙъИзПВ»ҜС§·ҙУҰЈә2SO2(g)Ј«O2(g)![]() 2SO3(g) ҰӨHЈҪЈӯ196.6kJЎӨmolЈӯ1ЎЈТ»¶ЁОВ¶ИПВЈ¬ПтјЧЎўТТЎўұыИэёцИЭ»эҫщОӘ2LөДәгИЭГЬұХИЭЖчЦРН¶ИлSO2(g)әНO2(g)Ј¬ЖдЖрКјОпЦКөДБҝј°SO2өДЖҪәвЧӘ»ҜВКИзұнЛщКҫЈ¬ПВБРЕР¶ПЦРЈ¬ХэИ·өДКЗЈЁ Ј©
2SO3(g) ҰӨHЈҪЈӯ196.6kJЎӨmolЈӯ1ЎЈТ»¶ЁОВ¶ИПВЈ¬ПтјЧЎўТТЎўұыИэёцИЭ»эҫщОӘ2LөДәгИЭГЬұХИЭЖчЦРН¶ИлSO2(g)әНO2(g)Ј¬ЖдЖрКјОпЦКөДБҝј°SO2өДЖҪәвЧӘ»ҜВКИзұнЛщКҫЈ¬ПВБРЕР¶ПЦРЈ¬ХэИ·өДКЗЈЁ Ј©
јЧ | ТТ | ұы | ||
ЖрКјОпЦКөДБҝ | n(SO2)/mol | 0.6 | 1.2 | 1.2 |
n(O2)/mol | 0.36 | 0.36 | 0.72 | |
SO2өДЖҪәвЧӘ»ҜВК | 80% | ҰБ1 | ҰБ2 | |
A.јЧЎъТТЈ¬ЖҪәвПтХэ·ҙУҰ·ҪПтТЖ¶ҜЈ¬ҰБ(O2)ФцҙуЈ¬·ЕіцөДИИБҝОӘ47.18kJ
B.ЖҪәвКұЈ¬ұыЦРc(SO2)КЗјЧЦРөД2ұ¶
C.ЖҪәвКұЈ¬SO2өДЧӘ»ҜВКЈәҰБ2>80%>ҰБ1
D.ёГОВ¶ИПВЈ¬ЖҪәвіЈКэKЈҪ400
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБР№ШУЪ°ў·ьјУөВВЮіЈКэNAөДЛө·ЁХэИ·өДКЗЈЁ Ј©
A.ұкҝцПВ11.2LHClЖшМеИЬУЪ0.5LЛ®ЦРЈ¬ЛщөГИЬТәЦРә¬ClЈӯ КэДҝОӘNA
B.NAёцFeЈЁOHЈ©3ҪәМеБЈЧУөДЦКБҝОӘ107g
C.20gD2OәНH218OЦРә¬УРөДЦКЧУКэОӘ10NA
D.ФЪөзҪвҫ«Б¶Нӯ№эіМЦРЧӘТЖБЛNA ёцөзЧУЈ¬Сфј«ИЬҪвБЛ32gНӯ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝИзНјЛщКҫЈ¬ФЪТ»ёцГЬұХөДІЈБ§№ЬБҪ¶Лёч·ЕТ»НЕГЮ»ЁЈ¬ФЩУГЧўЙдЖчН¬КұФЪБҪ¶ЛЧўИлККБҝөДЕЁ°ұЛ®әНЕЁСОЛбЈ¬ПВБРЛө·ЁІ»ХэИ·өДКЗЈЁ Ј©
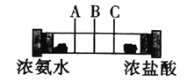
A.ІЈБ§№ЬЦР·ўЙъөД·ҙУҰҝЙұнКҫОӘЈәNH3Ј«HClЈҪNH4Cl
B.УГКЦҙҘГюІЈБ§№ЬНвұЪЈ¬»бёРҫхөҪУРИИБҝ·Еіц
C.КөСйКұ»бФЪІЈБ§№ЬөДBҙҰёҪҪьҝҙөҪ°ЧОн
D.Ҫ«ЕЁСОЛб»»іЙЕЁПхЛбТІ»бУРПаЛЖПЦПу
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ¶МЦЬЖЪФӘЛШAЎўBЎўCЎўDЎўEФЪФӘЛШЦЬЖЪұнЦРөДПа¶ФО»ЦГИзНјЛщКҫЈ¬ЖдЦРDФӯЧУөДЦКЧУКэКЗЖдMІгөзЧУКэөДИэұ¶Ј¬ПВБРЛө·ЁХэИ·өДКЗЈЁ Ј©
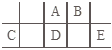
A.AөДЗв»ҜОп·РөгұИDөДёЯЈ¬ТтОӘAөДЗв»ҜОп·ЦЧУДЪҙжФЪЗвјь
B.№ӨТөЙПіЈУГCУлEРОіЙөД»ҜәПОпАҙ»сөГCөДөҘЦК
C.јтөҘАлЧУөД°лҫ¶УЙҙуөҪРЎОӘЈәEЈҫAЈҫBЈҫC
D.DЎўEБҪФӘЛШРОіЙөД»ҜәПОпГҝЦЦФӯЧУЧоНвІгТ»¶Ё¶јҙпөҪБЛ8e-ОИ¶ЁҪб№№
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРУР№ШЛДёціЈУГөз»ҜС§Ч°ЦГөДРрКцЦРЈ¬ХэИ·өДКЗ![]() ЎЎЎЎ
ЎЎЎЎ![]()
|
|
|
|
НјўсјоРФРҝГМөзіШ | НјўтЗҰРоөзіШ | НјўуөзҪвҫ«Б¶Нӯ | НјўфЗвСхИјБПөзіШ |
A. НјўсЛщКҫөзіШЦРЈ¬MnO2КЗХэј«Ј¬өзј«·ҙУҰКҪКЗ2H2O+2e-=H2Ўь+2OH-
B. НјўтЛщКҫөзіШ·Еөз№эіМЦРЈ¬өұНвөзВ·НЁ№э1molөзЧУКұЈ¬АнВЫЙПёәј«°еөДЦКБҝФцјУ96g
C. НјўуЛщКҫЧ°ЦГ№ӨЧч№эіМЦРЈ¬Сфј«ЦКБҝјхЙЩБҝөИУЪТхј«өДЦКБҝФцјУБҝ
D. НјўфЛщКҫөзіШЦРЈ¬І»№ЬKOHИЬТә»»іЙH2SO4ИЬТә»№КЗNa2SO4ИЬТәЈ¬өзіШөДЧЬ·ҙУҰКҪІ»ұд
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ2HI(g) ![]() H2(g)+I2(g)·ҙУҰ№эіМЦРДЬБҝұд»ҜИзНјЛщКҫ(НјЦРE1 ұнКҫХэ·ҙУҰөД»о»ҜДЬЈ¬E2 ұнКҫДж·ҙУҰөД»о»ҜДЬ)ЎЈ
H2(g)+I2(g)·ҙУҰ№эіМЦРДЬБҝұд»ҜИзНјЛщКҫ(НјЦРE1 ұнКҫХэ·ҙУҰөД»о»ҜДЬЈ¬E2 ұнКҫДж·ҙУҰөД»о»ҜДЬ)ЎЈ
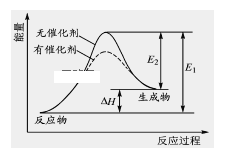
ПВБРУР№ШРрКцХэИ·өДКЗЎЎ(ЎЎЎЎ)
A.ЙэёЯОВ¶ИЈ¬·ҙУҰЛЩВКФцҙуЈ¬ЎчHјхРЎ
B.ЙэёЯОВ¶ИЈ¬І»У°Пм»о»Ҝ·ЦЧУ°Щ·ЦКэ
C.Дж·ҙУҰөД»о»ҜДЬөИУЪХэ·ҙУҰөД»о»ҜДЬ
D.ҙЯ»ҜјБДЬҪөөНёГ·ҙУҰөД»о»ҜДЬ
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com