
【题目】下列关于阿伏加德罗常数NA的说法正确的是( )
A.标况下11.2LHCl气体溶于0.5L水中,所得溶液中含Cl- 数目为NA
B.NA个Fe(OH)3胶体粒子的质量为107g
C.20gD2O和H218O中含有的质子数为10NA
D.在电解精炼铜过程中转移了NA 个电子,阳极溶解了32g铜
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,D是具有果香气味的烃的衍生物.A、B、C、D在一定条件下存在如下转化关系![]() 部分反应条件、产物被省略
部分反应条件、产物被省略![]() .
.
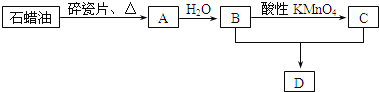
(1)工业上,由石油获得石蜡油的方法是______,由石蜡油获得A是______![]() 填“物理”或“化学”
填“物理”或“化学”![]() 变化.
变化.
(2)![]() 的化学式是______;
的化学式是______;![]() 的反应类型是______反应;写出反应
的反应类型是______反应;写出反应![]() 的化学方程式:______
的化学方程式:______
(3)丁烷是由石蜡油获得A的过程中的中间产物之一,写出它的两种同分异构体的结构简式:______、______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种说法不正确的是( )
A.仅用溴水一种试剂可将苯、己烯、乙醇、四氯化碳、亚硫酸钠溶液五种物质鉴别开来
B.![]() 中既含离子键又含共价键,其所含的阳离子对阴离子的个数比为2:1
中既含离子键又含共价键,其所含的阳离子对阴离子的个数比为2:1
C.甲烷、新戊烷与2,2,3,![]() 四甲基丁烷的一氯代物均只有一种
四甲基丁烷的一氯代物均只有一种
D.硬脂酸![]() 与乙酸、甲醇与乙二醇
与乙酸、甲醇与乙二醇![]() 均互为同系物关系
均互为同系物关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1g氢气完全燃烧生成液态水时放出热量143kJ,18g水蒸气变成液态水放出44kJ的热量。其他相关数据如下表:
化学键 | O=O | H—H | H—O(g) |
1 mol化学键断裂时 需要吸收的能量/kJ | 496 | x | 463 |
则表中x为( )
A.920B.557C.436D.188
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1807年化学家戴维电解熔融氢氧化钠制得钠:4NaOH(熔融)![]() O2↑+4Na+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe+4NaOH=Fe3O4+2H2↑+4Na↑。下列有关说法正确的是
O2↑+4Na+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe+4NaOH=Fe3O4+2H2↑+4Na↑。下列有关说法正确的是
A. 戴维法制钠,阳极的电极反应式为:Na++e-=Na↑
B. 盖·吕萨克法制钠原理是利用铁的金属性比钠的强
C. 若用戴维法与盖·吕萨克法制得等量的钠,两方法转移电子总数相等
D. 还可以用电解熔融氯化钠法制钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某香料F的合成路径如图所示![]() 部分产物略去
部分产物略去![]() 。
。

已知:①同一个碳原子上连接有两个羟基时不稳定,会自动脱水
②![]()
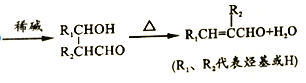
请回答下列问题:
![]()
![]() 的系统命名为______;A的结构简式为___________。
的系统命名为______;A的结构简式为___________。
![]() 含有的官能团名称是 ______________。
含有的官能团名称是 ______________。
![]() 写出步骤III第①步反应的化学方程式_____________;反应Ⅱ的反应类型为_____。
写出步骤III第①步反应的化学方程式_____________;反应Ⅱ的反应类型为_____。
![]() 在引发剂作用下,D可以缩聚合成高聚物,其化学方程式____________________。
在引发剂作用下,D可以缩聚合成高聚物,其化学方程式____________________。
![]() 物质G的化学式为
物质G的化学式为![]() ,同时满足下列条件的G的同分异构体有_____
,同时满足下列条件的G的同分异构体有_____![]() 写结构简式
写结构简式![]() 。
。
①核磁共振氢谱显示苯环上有四种不同的氢
②常温下,能与![]() 溶液反应产生气体
溶液反应产生气体
③遇氯化铁溶液会显色
![]() 结合上述合成方法,以乙醇为原料,无机试剂任选,设计合成聚
结合上述合成方法,以乙醇为原料,无机试剂任选,设计合成聚![]() 丁烯醛
丁烯醛![]() 的线路图:__________________________________________________。合成路线示例如下:CH2=CH2
的线路图:__________________________________________________。合成路线示例如下:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C三种烃的衍生物,相互转化关系如下:
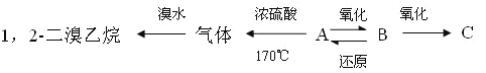
其中B可发生银镜反应,C跟石灰石反应产生能使澄清石灰水变浑浊的气体.
(1)A、B、C的结构简式和名称依次是__、__、__;
(2)写出下列反应的化学方程式
A→B__;
B→C__;
B→A__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推断正确的是( )
A.BF3是三角锥形分子
B.NH4+的电子式: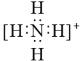 ,离子呈平面形结构
,离子呈平面形结构
C.CH4分子中的4个C—H键都是氢原子的1s轨道与碳原子的p轨道形成的sp σ键
D.CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C—H σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素的单质和化合物种类很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。回答下列问题:
(1)溴原子的价层电子排布图为_______。根据下表提供的第一电离能数据,判断最有可能生成较稳定的单核阳离子的卤素原子是________(填元素符号)。
氟 | 氯 | 溴 | 碘 | |
第一电离能/ (kJ·mol-1) | 1 681 | 1 251 | 1 140 | 1 008 |
(2)氢氟酸在一定浓度的溶液中主要以二分子缔合[(HF)2]形式存在,使氟化氢分子缔合的相互作用是____________。碘在水中溶解度小,但在碘化钾溶液中明显增大,这是由于发生反应:I-+I2=I3-,CsICl2与KI3类似,受热易分解,倾向于生成晶格能更大的物质,试写出CsICl2受热分解的化学方程式:_________________________________。
(3)ClO2-中心氯原子的杂化轨道类型为________,与ClO2-具有相同立体构型和键合形式的物质的化学式为____________(写出一个即可)。
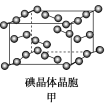
(4)如图甲为碘晶体晶胞结构,平均每个晶胞中有________个碘原子,碘晶体中碘分子的配位数为____________。
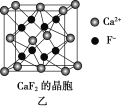
(5)已知NA为阿伏加德罗常数,CaF2晶体密度为ρ g·cm-3,其晶胞如图乙所示,两个最近Ca2+核间距离为a nm,则CaF2的相对分子质量可以表示为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com