
【题目】下列推断正确的是( )
A.BF3是三角锥形分子
B.NH4+的电子式: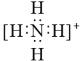 ,离子呈平面形结构
,离子呈平面形结构
C.CH4分子中的4个C—H键都是氢原子的1s轨道与碳原子的p轨道形成的sp σ键
D.CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C—H σ键
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.已知一氧化碳与水蒸气反应过程的能量变化如图所示:
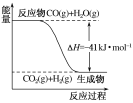
(1)反应的热化学方程式为___________________________。
(2)已知:Ti(s) +2Cl2(g) = TiCl4(l) △H = -804.2kJ/mol;
2Na(s) +Cl2(g) = 2NaCl(s) △H = -882.0kJ/mol
Na(s) = Na(l) △H =+2.6 kJ/mol
请写出用液态钠与四氯化钛置换出钛的热化学方程式_____________________________________
II.在某一容积为2 L的密闭容器内,加入0.8 mol的H2和0.6 mol的I2,在一定条件下发生如下反应:H2(g)+I2(g)![]() 2HI(g) ΔH<0,反应中各物质的浓度随时间变化情况如下图甲所示:
2HI(g) ΔH<0,反应中各物质的浓度随时间变化情况如下图甲所示:

(3)该反应的化学平衡常数表达式为________。
(4)根据图甲数据,反应开始至达到平衡时,平均速率v(HI)为________。
(5)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K________(填“增大”“减小”或“不变”),HI浓度的变化正确的是________(用图乙中a~c的编号回答)。
②若加入I2,H2浓度的变化正确的是________(用图乙中d~f的编号回答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于阿伏加德罗常数NA的说法正确的是( )
A.标况下11.2LHCl气体溶于0.5L水中,所得溶液中含Cl- 数目为NA
B.NA个Fe(OH)3胶体粒子的质量为107g
C.20gD2O和H218O中含有的质子数为10NA
D.在电解精炼铜过程中转移了NA 个电子,阳极溶解了32g铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中D原子的质子数是其M层电子数的三倍,下列说法正确的是( )
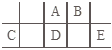
A.A的氢化物沸点比D的高,因为A的氢化物分子内存在氢键
B.工业上常用C与E形成的化合物来获得C的单质
C.简单离子的半径由大到小为:E>A>B>C
D.D、E两元素形成的化合物每种原子最外层一定都达到了8e-稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是常用来衡量一个国家石油化工发展水平的标志性物质,A、B、C、D、E、F、G均为有机物,他们之间有如图转化关系,请回答下列问题:

(1)写出A中官能团的名称:A________ , B中官能团的电子式B________ 。
(2)在F的同系物中最简单的有机物的空间构型为________ 。
(3)写出与F互为同系物的含5个碳原子的所有同分异构体中一氯代物种类最少的物质的结构简式:___________________________________________ 。
(4)写出下列编号对应反应的化学方程式,并注明反应类型:
④_____________________________ ,________反应 ;
⑦_____________________________ ,________反应 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关四个常用电化学装置的叙述中,正确的是![]()
![]()
|
|
|
|
图Ⅰ碱性锌锰电池 | 图Ⅱ铅蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ氢氧燃料电池 |
A. 图Ⅰ所示电池中,MnO2是正极,电极反应式是2H2O+2e-=H2↑+2OH-
B. 图Ⅱ所示电池放电过程中,当外电路通过1mol电子时,理论上负极板的质量增加96g
C. 图Ⅲ所示装置工作过程中,阳极质量减少量等于阴极的质量增加量
D. 图Ⅳ所示电池中,不管KOH溶液换成H2SO4溶液还是Na2SO4溶液,电池的总反应式不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(16分)肉桂酸甲酯G是一种用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,它的分子式为C10H10O2,用芳香烃A为原料合成肉桂酸甲酯G的路线如下:
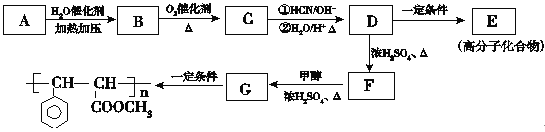
已知: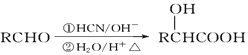
(1)B的官能团的名称________。
(2)D→F的反应类型是________。
(3)肉桂酸甲酯的结构简式为_________。
(4)写出A的结构简式___________。
(5)C与银氨溶液反应的化学方程式________。
(6)D转化为E的化学方程式_________。
(7)写出![]() 与足量氢氧化钠溶液反应的化学方程式________。
与足量氢氧化钠溶液反应的化学方程式________。
(8)写出符合下列条件的D的同分异构体的结构简式_______。
①苯环上有两个取代基且苯环上的一氯代物有两种;
②遇FeCl3溶液显紫色
③在NaOH溶液中反应最多能消耗3mol NaOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:

已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(2)步骤Ⅱ合成N2H4·H2O的装置如题19图1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、![]() 、
、![]() 随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
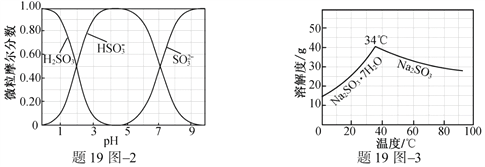
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬酸(用HR 表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的含量随pH的变化如图所示。下列说法正确的是
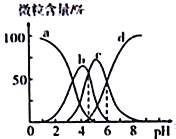
A. H3R的第二步电离常数Ka2(H3R)的数量级为10-4
B. pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
C. Na2HR溶液中HR2-的水解程度大于电离程度
D. pH=4时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com