
【题目】Ⅰ.已知一氧化碳与水蒸气反应过程的能量变化如图所示:
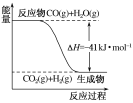
(1)反应的热化学方程式为___________________________。
(2)已知:Ti(s) +2Cl2(g) = TiCl4(l) △H = -804.2kJ/mol;
2Na(s) +Cl2(g) = 2NaCl(s) △H = -882.0kJ/mol
Na(s) = Na(l) △H =+2.6 kJ/mol
请写出用液态钠与四氯化钛置换出钛的热化学方程式_____________________________________
II.在某一容积为2 L的密闭容器内,加入0.8 mol的H2和0.6 mol的I2,在一定条件下发生如下反应:H2(g)+I2(g)![]() 2HI(g) ΔH<0,反应中各物质的浓度随时间变化情况如下图甲所示:
2HI(g) ΔH<0,反应中各物质的浓度随时间变化情况如下图甲所示:

(3)该反应的化学平衡常数表达式为________。
(4)根据图甲数据,反应开始至达到平衡时,平均速率v(HI)为________。
(5)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K________(填“增大”“减小”或“不变”),HI浓度的变化正确的是________(用图乙中a~c的编号回答)。
②若加入I2,H2浓度的变化正确的是________(用图乙中d~f的编号回答)。
【答案】CO(g)+H2O(g)==CO2(g)+H2(g) △H = -41kJ/mol 4Na(s)+ TiCl4(l)= Ti(s)+ 4NaCl(s) △H = -970.2kJ/mol K=![]() 0.17 mol·L-1·min-1 减小 c f
0.17 mol·L-1·min-1 减小 c f
【解析】
(1)根据图象中反应物总能量与生成物总能量进行分析得出热化学方程式;
(2)根据盖斯定律进行求算;
(3)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算;
(4)根据v=![]() 计算平均速率v(HI);
计算平均速率v(HI);
(5)①根据化学平衡常数K只与温度有关,温度改变,若平衡正向移动,化学平衡常数K增大,生成物浓度增大,反之,若平衡逆向移动,化学平衡常数K减少,生成物浓度减少;
②若加入I2,平衡正向移动,H2浓度减少。
(1)图象分析判断反应物能量高于生成物的能量,反应是放热反应;反应的焓变为41 kJ/mol;反应的热化学方程式为:CO(g)+H2O(g)==CO2(g)+H2(g) △H = -41kJ/mol;
(2)由已知反应得:
Ti(s) +2Cl2(g) = TiCl4(l) △H = -804.2kJ/mol①
2Na(s) +Cl2(g) = 2NaCl(s) △H = -882.0kJ/mol②
Na(s) = Na(l) △H =+2.6 kJ/mol③
根据盖斯定律,将①+②-③得:4Na(s)+ TiCl4(l)= Ti(s)+ 4NaCl(s) ΔH=+804.2 kJ/mol-1 764.0 kJ/mol-10.4 kJ/mol=-970.2 kJ/mol;
(3)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值。根据方程式H2(g)+I2(g)![]() 2HI(g)可知,该反应的平衡常数表达式是K=
2HI(g)可知,该反应的平衡常数表达式是K=![]() ;
;
(4)平均速率v(HI)=![]() =0.17 mol·L-1·min-1;
=0.17 mol·L-1·min-1;
(5)①该反应放热,升高温度,平衡逆向移动,化学平衡常数K减少,生成物浓度减少,故答案为:减小;c;
②若加入I2,平衡正向移动,H2浓度减少,故答案为:f。


科目:高中化学 来源: 题型:
【题目】某温度下,在2 L的密闭容器中,加入1mol X(g)和2 mol Y(g)发生反应:X(g)+mY(g)![]() 3Z(g) ΔH<0,平衡时,X和Y的转化率都是10%。下列叙述不正确的是
3Z(g) ΔH<0,平衡时,X和Y的转化率都是10%。下列叙述不正确的是
A.m=2
B.达平衡时,Z的体积分数为10%
C.达平衡后,保持容器体积不变,加热,容器内压强将增大
D.将平衡后的容器体积压缩至1L,X的浓度为0.45mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,D是具有果香气味的烃的衍生物.A、B、C、D在一定条件下存在如下转化关系![]() 部分反应条件、产物被省略
部分反应条件、产物被省略![]() .
.
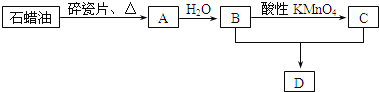
(1)工业上,由石油获得石蜡油的方法是______,由石蜡油获得A是______![]() 填“物理”或“化学”
填“物理”或“化学”![]() 变化.
变化.
(2)![]() 的化学式是______;
的化学式是______;![]() 的反应类型是______反应;写出反应
的反应类型是______反应;写出反应![]() 的化学方程式:______
的化学方程式:______
(3)丁烷是由石蜡油获得A的过程中的中间产物之一,写出它的两种同分异构体的结构简式:______、______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知无水AlCl3遇潮湿空气即产生大量白雾,实验室可用如图所示装置制备AlCl3。
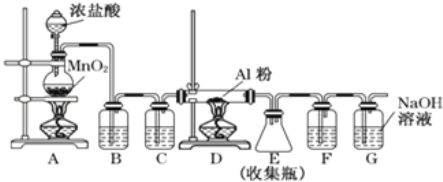
(1)装置A中发生反应的离子方程式为________________________________________
(2)装置B盛放的试剂是______,其作用是_______________________________;装置C盛放的试剂是__________,其作用是__________________________________
(3)装置G的作用是________________,G中发生反应的化学方程式是________________________________________
(4)F中盛放的试剂是______,其作用是___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH ![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意完成下列问题。
(1)将等质量的锌粉分别投入10 mL 0.1 mol·L-1盐酸和10 mL 0.1 mol·L-1 CH3COOH溶液中。若锌不足量,反应快的是________(填写盐酸溶液、醋酸溶液)。
(2)将等量的锌粉分别投入c(H+)均为1 mol·L-1、体积均为10 mL的盐酸和醋酸溶液中。若锌不足量,反应快的是________(填写盐酸溶液、醋酸溶液)。
(3)设水的电离平衡线如图所示。
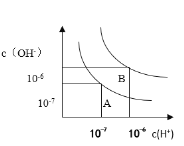
a.若以A点表示25°时水在电离平衡时的粒子浓度,当温度升高到100°时,水的电离平衡状态到B点,则此时水的离子积增加到____________;
b.将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持在100°的恒温,欲使混合溶液的pH=7,则Ba(OH) 2溶液和盐酸的体积比为___________。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合溶液pH=6,则溶液中c(CH3COO-)-c(Na+)=________ mol/L (填准确数值)。
(5)已知NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO42-。某温度下,向c(H+)=1×10-6 mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的c(H+)=1×10-2 mol·L-1。下列对该溶液的叙述正确的是________________。
A.该温度高于25 ℃
B.由水电离出来的H+的浓度为1×10-10 mol·L-1
C.取该溶液加水稀释100倍,溶液中的水电离出的c(H+)减小
D.加入NaHSO4晶体抑制水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种说法不正确的是( )
A.仅用溴水一种试剂可将苯、己烯、乙醇、四氯化碳、亚硫酸钠溶液五种物质鉴别开来
B.![]() 中既含离子键又含共价键,其所含的阳离子对阴离子的个数比为2:1
中既含离子键又含共价键,其所含的阳离子对阴离子的个数比为2:1
C.甲烷、新戊烷与2,2,3,![]() 四甲基丁烷的一氯代物均只有一种
四甲基丁烷的一氯代物均只有一种
D.硬脂酸![]() 与乙酸、甲醇与乙二醇
与乙酸、甲醇与乙二醇![]() 均互为同系物关系
均互为同系物关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1g氢气完全燃烧生成液态水时放出热量143kJ,18g水蒸气变成液态水放出44kJ的热量。其他相关数据如下表:
化学键 | O=O | H—H | H—O(g) |
1 mol化学键断裂时 需要吸收的能量/kJ | 496 | x | 463 |
则表中x为( )
A.920B.557C.436D.188
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推断正确的是( )
A.BF3是三角锥形分子
B.NH4+的电子式: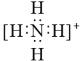 ,离子呈平面形结构
,离子呈平面形结构
C.CH4分子中的4个C—H键都是氢原子的1s轨道与碳原子的p轨道形成的sp σ键
D.CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C—H σ键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com