
����Ŀ���о�ȼ�ϵ�ȼ�պͶ���Ⱦ���������������������ڷ�ֹ������Ⱦ����Ҫ���塣
��1����úת��Ϊ�������ȼ�ϣ���֪��H2(g)+1/2O2(g)=H2O(g)![]() H= 241��8kJ/mol��C(s)+1/2O2(g)=CO(g)
H= 241��8kJ/mol��C(s)+1/2O2(g)=CO(g)![]() H= 110��5kJ/mol��д����̿��ˮ������Ӧ��H2��CO���Ȼ�ѧ����ʽ________________________��
H= 110��5kJ/mol��д����̿��ˮ������Ӧ��H2��CO���Ȼ�ѧ����ʽ________________________��
��2��һ�������£����ܱ������ڣ�SO2��������SO3���Ȼ�ѧ����ʽΪ��2SO2(g)+O2(g)![]() 2SO3(g)����H=a kJ/mo1������ͬ������Ҫ��õ�2akJ��������������ʵ����ʵ���������____________
2SO3(g)����H=a kJ/mo1������ͬ������Ҫ��õ�2akJ��������������ʵ����ʵ���������____________
A��4mo1 SO2��2mol O2���������� B��4mol SO2��2mo1 O2��2mol SO3
C��4mol SO2��4mo1 O2������ D��6mo1 SO2��4mo1 O2
��3������β����NOx��CO�����ɼ�ת����
����֪����������NO�ķ�ӦΪ��N2(g)+O2(g)![]() 2NO(g)
2NO(g)![]() H��0����һ���¶��µĶ����ܱ������У���˵���˷�Ӧ�Ѵ�ƽ�����__________
H��0����һ���¶��µĶ����ܱ������У���˵���˷�Ӧ�Ѵ�ƽ�����__________
A��ѹǿ���� B���������ƽ����Է�����������
C��2v��(N2)��v��(NO) D�� N2������������ٸı�
������ȼ�Ͳ���ȫȼ��ʱ����CO���������밴���з�Ӧ��ȥCO��2CO(g)=2C(s)+O2(g)![]() H��0�������������ܷ�ʵ�ֵ�����_______________________________________________��
H��0�������������ܷ�ʵ�ֵ�����_______________________________________________��
��4��ȼ��CO��H2��һ�������¿����ת����CO(g)��H2O(g)![]() CO2(g)��H2(g)����420��ʱ��ƽ�ⳣ��K=9������Ӧ��ʼʱ��CO��H2O��Ũ�Ⱦ�Ϊ0��1mol/L����CO�ڴ˷�Ӧ�����µ�ת����Ϊ______________��
CO2(g)��H2(g)����420��ʱ��ƽ�ⳣ��K=9������Ӧ��ʼʱ��CO��H2O��Ũ�Ⱦ�Ϊ0��1mol/L����CO�ڴ˷�Ӧ�����µ�ת����Ϊ______________��
���𰸡�C(s)+H2O(g)=CO(g)+H2(g)![]() H=+131.3kJ/mol D CD �÷�Ӧ���������ؼ��ķ�Ӧ ����
H=+131.3kJ/mol D CD �÷�Ӧ���������ؼ��ķ�Ӧ ����![]() G=
G=![]() H��T
H��T![]() S,
S,![]() G��0,����ʵ�� 75%
G��0,����ʵ�� 75%
��������
��1�����ݸ�˹���ɽ��з�����
��2�����ݿ��淴Ӧ�ص���з�����
��3���ٸ��ݿ��淴Ӧ�ﵽƽ������淴Ӧ������ȣ�����ֵ�Ũ�ȼ��ɴ����������������������з�����
�ڸ��ݷ�Ӧ���ص�ȷ��![]() H��S�ı仯���������
H��S�ı仯���������![]() G=
G=![]() H��T
H��T![]() S�ж���Ӧ�ܹ�������
S�ж���Ӧ�ܹ�������
��4����������ʽ�����ƽ��ʱ�����ʵ�Ũ�ȣ�Ȼ�����K= ![]() ��ʽ��������ֵ���м��㡣
��ʽ��������ֵ���м��㡣
��1����֪��H2(g)+![]() O2(g)=H2O(g)
O2(g)=H2O(g)![]() H1= 241.8kJ/mol ��C(s)+
H1= 241.8kJ/mol ��C(s)+ ![]() O2(g)=CO(g)
O2(g)=CO(g)![]() H2= 110.5kJ/mol���ݸ�˹���ɣ��÷���ʽ2��ȥ����ʽ1���ɵã�д����̿��ˮ������Ӧ��H2��CO���Ȼ�ѧ����ʽ��1��C(s)+H2O(g)=CO(g)+H2(g)
H2= 110.5kJ/mol���ݸ�˹���ɣ��÷���ʽ2��ȥ����ʽ1���ɵã�д����̿��ˮ������Ӧ��H2��CO���Ȼ�ѧ����ʽ��1��C(s)+H2O(g)=CO(g)+H2(g)![]() H=+131.3kJ/mol��
H=+131.3kJ/mol��
��2���ɷ�Ӧ����ʽ��֪����2mol��SO3ʱ����a kJ����õ�2a kJ��������������4molSO3�����ڷ�Ӧ�ǿ��淴Ӧ����������ȫ���е��ף�����Ҫ�õ�4molSO3��SO2��O2���ʵ�������Ҫ����4mol�� 2mol����D���ϣ�Bѡ���м�������Ӧ�����淴Ӧ�����շų�������С��2akJ����ѡD��
��3����A�����ڷ�Ӧǰ��������䣬��ѹǿʼ�ղ��䲻����Ϊƽ���ж����ݣ�A����
B�����ڷ�Ӧǰ���������������ʵ��������ı䣬�ʻ������ƽ����Է����������䣬�ʲ�����Ϊƽ���ж����ݣ�B����
C. 2v��(N2)��v��(NO)= v��(NO)���������淴Ӧ������ȣ�������֮�Ⱥ�ϵ�������ȹ��ɣ������ж���Ӧ�ﵽƽ��״̬����C��ȷ��
D. N2������������ٸı䣬���淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬����D��ȷ��
�ʴ�ѡCD��
���ɷ�Ӧ2CO(g)=2C(s)+O2(g)![]() H��0����֪�÷�Ӧ���������ؼ��ķ�Ӧ������
H��0����֪�÷�Ӧ���������ؼ��ķ�Ӧ������![]() G=
G=![]() H��T
H��T![]() S��
S��![]() G��0������ʵ�֣�
G��0������ʵ�֣�
��4����ƽ��ʱCO��Ũ�ȱ仯��Ϊxmol/L����
CO��g��+H2O��g��CO2��g��+H2��g��
��ʼ��mol/L����0.1 0.1 0 0
�仯��mol/L���� c c c c
ƽ�⣨mol/L���� 0.1-c 0. 1-c c c
��![]() =9 ���c=0��075����һ����̼�ڴ������µ�ƽ��ת����=75%��
=9 ���c=0��075����һ����̼�ڴ������µ�ƽ��ת����=75%��
�ʴ�Ϊ75%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ���У�a��b���Ƕ��Ե缫��ͨ��һ��ʱ���b��������Һ����ɫ������˵���в���ȷ����( )
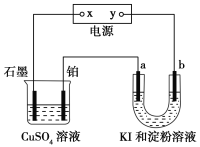
A��x��������y�Ǹ��� B��a������������b������I2
C��a����Pt�缫�������ݲ��� D��U�ι�����Һ�ļ�����ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(H2C2O4)�Ƕ�Ԫ���ᣬNaHC2O4��Һ�����ԡ������£���10 mL 0.01 mol/L NaHC2O4��Һ�еμ�0.01 mol/L NaOH��Һ������NaOH��Һ��������ӣ���Һ������Ũ�ȹ�ϵ�������( )
A.V(NaOH) = 0ʱ��c(H��) >1��10��7mol/L
B.V(NaOH)��10 mLʱ�����ܴ���c(Na��) = 2c(C2O42-)��c(HC2O4- )
C.V(NaOH) = 10 mLʱ����Һ��pHΪ9����10-9= 10-5-2c(H2C2O4)-c(HC2O4-)
D.V(NaOH)��10 mLʱ�����ܴ���c(OH- )��c(Na��)��c(C2O42-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨ����ѪҺ��Ca2���ĺ�������������·�����
![]()
�йط�Ӧ�Ļ�ѧ����ʽΪ��2KMnO4+5H2C2O4+3H2SO4 K2SO4+2MnSO4+10CO2��+8H2O��ѪҺ��ƷΪ15mL���ζ����ɵIJ���������0.001mol��L��1��KMnO4��Һ15.0mL��������ѪҺ��Ʒ�еĺ�����Ϊ
A.0.001mol��L��1B.0.0025mol��L��1 C.0.0003mol��L��1D.0.0035mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������·������·�Ӧ��COCl2(g)![]() CO(g)+Cl2(g) ��H<0�����й�˵����ȷ����
CO(g)+Cl2(g) ��H<0�����й�˵����ȷ����
A����λʱ��������CO��Cl2�����ʵ�����Ϊ1��1ʱ����Ӧ�ﵽƽ��״̬
B���ô�������߷�Ӧ���ƽ��ת����
C��ƽ��ʱ�����������䣬�����¶������COCl2��ת����
D������Ӧ��ƽ��ʱ�����º�ѹ������ͨ��Ar�����COCl2��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�һ�����![]() �Ķ�Ԫ����
�Ķ�Ԫ����![]() ��Һ��һ�����
��Һ��һ�����![]() ��NaOH��Һ��Ϻ���Һ�����ԣ������ж���ȷ����
��NaOH��Һ��Ϻ���Һ�����ԣ������ж���ȷ����![]()
A.��Һ��![]()
B.��Һ��![]()
C.��Һ��![]()
D.��Һ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���ij�ݻ��㶨���ܱ������г���1 mol N2��3 mol H2������ַ�Ӧ��ﵽ����ƽ�⣺N2(g)��3H2(g)![]() 2NH3(g)�������й�˵������ȷ���ǣ� ��
2NH3(g)�������й�˵������ȷ���ǣ� ��
A. ��ƽ����ټ���һ������N2����ϵ�ڸ����ʺ�������
B. N2��H2��NH3��Ũ��һ�����
C. ��Ӧû�дﵽƽ��ʱ��NH3��ϵطֽ⣬�ﵽƽ��ʱ���ٷֽ�
D. ƽ��ʱ��N2��H2���ʵ���֮��Ϊ1��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ά����A�Ľṹ��ʽ��дΪ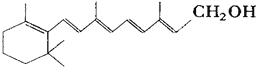 ��ʽ������ʾ�����ߵĽ�����˵㴦����̼ԭ�ӣ�������ԭ���������ļۣ���C��Hԭ��δ��dz���������������������ȷ���ǣ� ��
��ʽ������ʾ�����ߵĽ�����˵㴦����̼ԭ�ӣ�������ԭ���������ļۣ���C��Hԭ��δ��dz���������������������ȷ���ǣ� ��
A.ά����A�ķ���ʽΪC20H30O
B.ά����A��һ��������ˮ�Ĵ�
C.ά����A�������������ϩ��̼���ṹ
D.1molά����A�ڴ���������������5molH2�����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������[CO(NH2)2]���ǵ�����Ҫ������ڹ�ũҵ������Ӧ�ù㷺��
��1����֪��N2(g)��3H2(g)![]() 2NH3(g)��H����92kJ��mol-1
2NH3(g)��H����92kJ��mol-1
��ȡ1molN2(g)��3molH2(g)����һ�ܱ������У��ڴ�������ʱ���з�Ӧ����÷�Ӧ�ų�������____92.2kJ(������������������������)��ԭ����_______________��
��ʹ�ô������÷�Ӧ��H_____(�������������С������������)��
����֪���ֱ��ƻ�1molN��N����1molH��H����Ҫ���յ�����Ϊ��946kJ��436kJ�����ƻ�1molN��H����Ҫ���յ�����Ϊ_____��
�ܵ��ݻ�һ��ʱ�����жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬��������_______________
a����������ѹǿ���� b�����������c��CO������ c��v����H2��=v�棨N2��
d��c��H2��=c��NH3�� e. ��������ܶȲ��ٱ仯 f.��ɫ���ٱ仯
g. �������ƽ����Է����������ٱ仯
��2����CO2��NH3Ϊԭ�Ͽɺϳɻ�������[CO(NH2)2]����֪��
��.2NH3(g)+CO2(g)==NH2CO2NH4(s)��H����159.5kJ/mol
��.NH2CO2NH4(s)==CO(NH2)2(s)+H2O(g)��H��+116.5kJ/mol
��.H2O(l)==H2O(g)��H��+44.0kJ/mol
��д��CO2��NH3�ϳ����غ�Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽ_______________________��
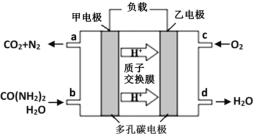
�ڻ�ѧ�������о����ض���ȼ�ϵ�ء������ֵ��ֱ��ȥ�����з�ˮ�е����أ����ܲ���������ˮ�����ܷ��磬����ȼ�ϵ�ؽṹ��ͼ��ʾ,�ش��������⣺
����еĸ���Ϊ_____(����������������)���ҵĵ缫��ӦʽΪ_____________����ع���ʱ��������ÿ����1mol���أ�����O2�����(��״����)ԼΪ_____L��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com