
【题目】氨、尿素[CO(NH2)2]都是氮的重要化合物,在工农业生产中应用广泛。
(1)已知:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92kJ·mol-1
2NH3(g)ΔH=-92kJ·mol-1
①取1molN2(g)和3molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量____92.2kJ(填“>”、“=”或“<”),原因是_______________。
②使用催化剂,该反应△H_____(填“变大”“变小”或“不变”)。
③已知:分别破坏1molN≡N键、1molH-H键需要吸收的能量为:946kJ、436kJ,则破坏1molN-H键需要吸收的能量为_____。
④当容积一定时,能判断该反应是否达到化学平衡状态的依据是_______________
a.容器中总压强不变 b.混合气体中c(CO)不变 c.v正(H2)=v逆(N2)
d.c(H2)=c(NH3) e. 混合气体密度不再变化 f.颜色不再变化
g. 混合气体平均相对分子质量不再变化
(2)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
Ⅰ.2NH3(g)+CO2(g)==NH2CO2NH4(s)△H=﹣159.5kJ/mol
Ⅱ.NH2CO2NH4(s)==CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
Ⅲ.H2O(l)==H2O(g)△H=+44.0kJ/mol
①写出CO2与NH3合成尿素和液态水的热化学反应方程式_______________________。
②化学家正在研究尿素动力燃料电池。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电,尿素燃料电池结构如图所示,回答下列问题:
电池中的负极为_____(填“甲”或“乙”),乙的电极反应式为_____________,电池工作时,理论上每净化1mol尿素,消耗O2的体积(标准状况下)约为_____L。
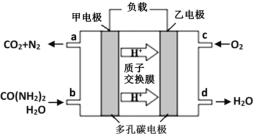
【答案】< 由于为可逆反应,反应物无法全部转化,1molN2和3molH2充分参与反应也不可能生成2molNH3,故放出的热量小于92kJ 不变 391 kJ a和g 2NH3(g)+CO2(g) == CO(NH2)2(s)+H2O(l) △H=﹣87.0kJ/mol 甲 O2+4e-+4H+=2H2O 33.6
【解析】
(1)①合成氨反应为可逆反应,不可能进行到底,故在实际生产中1molN2和3molH2不可能生成2molNH3,放出的热量也必定小于92kJ;
②催化剂改变反应速率不改变化学平衡及△H;
③△H=反应物的键能之和-生成物的键能之和;
④当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,以此判断;
(2)①根据盖斯定律计算;
②该电池CO(NH2)2在负极失电子生成二氧化碳和氮气,氧气在正极反应生成水,电解质溶液中含氢离子,该反应的总方程式为:2CO(NH2)2+3O2=2CO2+2N2+4H2O,结合2 CO(NH2)2~3O2计算,以此来解答。
(1)①N2(g)+3H2(g)2NH3(g)△H=-92 kJmol-1,N2和H2反应生成2 mol NH3时放出的热量为92.2 kJ,是指1 mol氮气和3 mol的氢气完全反应生成2 mol的氨气放出的热量为92.2 kJ,1mol N2和3 molH2放在密闭容器中不可能完全转化为氨气,所以放出热量一定小于92.2 kJ,故答案为:<;由于该反应是可逆反应,反应物无法全部转化为生成物;
②催化剂改变反应速率不改变化学平衡,反应热不变,故答案为:不变;
③分别破坏1 mol N≡N键、1 mol H-H键需要吸收的能量为:946 kJ、436 kJ,设破坏1 mol N-H键需要吸收的能量为x,根据N2(g)+3H2(g)2NH3(g)△H=-92 kJmol-1,焓变=反应物总键能-生成物的总键能,即946 kJ/mol+3×436 kJ/mol-6x=-92.2 kJ/mol,解得x=391 kJ/mol,即破坏1 mol N-H键需要吸收的能量为391 kJ,故答案为:391;
④a.容器容积一定,平衡正向移动时气体的物质的量减小,压强减小,所以容器中总压强不变可以说明反应达到平衡,故a符合;
b.混合气体无CO,所以混合气体中c(CO)不变不能说明反应达到平衡,故b不符合;
c.当反应达到平衡时v正(H2)=v逆(H2),v逆(H2)=3 v逆(N2),所以v正(H2)=v逆(N2)时不能说明反应达到平衡,故c不符合;
d.平衡正向移动时c(H2)减小,c(NH3)增大,可能有某一时刻c(H2)=c(NH3),但不能说明反应达到平衡,故d不符合;
e. 混合气体总体积不变,总质量不变,所以混合气体密度在平衡移动时不会发生变化,故e不符合;
f. 该反应中生成物和反应物均为无色气体,所以不会有颜色变化,故f不符合;
g. 混合气体的总质量不变,但平衡正向移动时混合气体的总物质的量减小,所以混合气体平均相对分子质量增大,当混合气体平均相对分子质量不再变化时说明反应达到平衡,故g符合;
故答案为:a和g
(2)①由Ⅰ.2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5kJmol-1
Ⅱ.NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.5kJmol-1
Ⅲ.H2O(l)=H2O(g)△H=+44.0kJmol-1
结合盖斯定律可知,①+②-③得到2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l),其△H=-159.5 kJmol-1+(+116.5kJmol-1)-(+44.0kJmol-1)=-87.0kJmol-1,则CO2与NH3合成尿素和液态水的热化学反应方程式为2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-87.0 kJ/mol,故答案为:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-87.0 kJ/mol;
②根据图示可知,甲电极上CO(NH2)2反应生成二氧化碳和氮气,N元素化合价升高,失电子,为电源的负极,电解质溶液为酸性,则乙电极为正极,发生还原反应,氧气得电子之后生成水,则其电极反应式为:O2+4e-+4H+=2H2O,该反应的总方程式为2CO(NH2)2+3O2=2CO2+2N2+4H2O,根据关系式2 CO(NH2)2~3O2可知,电池工作时,理论上每净化1mol尿素,消耗O2的体积为1.5 mol×22.4 L/mol=33.6 L,故答案为:甲;O2+4e-


科目:高中化学 来源: 题型:
【题目】研究燃料的燃烧和对污染气体产物的无害化处理,对于防止大气污染有重要意义。
(1)将煤转化为清洁气体燃料:已知:H2(g)+1/2O2(g)=H2O(g)![]() H= 241.8kJ/mol;C(s)+1/2O2(g)=CO(g)
H= 241.8kJ/mol;C(s)+1/2O2(g)=CO(g)![]() H= 110.5kJ/mol;写出焦炭与水蒸气反应制H2和CO的热化学方程式________________________。
H= 110.5kJ/mol;写出焦炭与水蒸气反应制H2和CO的热化学方程式________________________。
(2)一定条件下,在密闭容器内,SO2被氧化成SO3的热化学方程式为:2SO2(g)+O2(g)![]() 2SO3(g);△H=a kJ/mo1,在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是____________
2SO3(g);△H=a kJ/mo1,在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是____________
A.4mo1 SO2和2mol O2 B.4mol SO2、2mo1 O2和2mol SO3
C.4mol SO2和4mo1 O2 D.6mo1 SO2和4mo1 O2
(3)汽车尾气中NOx和CO的生成及转化:
①已知气缸中生成NO的反应为:N2(g)+O2(g)![]() 2NO(g)
2NO(g)![]() H>0,在一定温度下的定容密闭容器中,能说明此反应已达平衡的是__________
H>0,在一定温度下的定容密闭容器中,能说明此反应已达平衡的是__________
A.压强不变 B.混合气体平均相对分子质量不变
C.2v正(N2)=v逆(NO) D. N2的体积分数不再改变
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)![]() H>0,简述该设想能否实现的依据_______________________________________________。
H>0,简述该设想能否实现的依据_______________________________________________。
(4)燃料CO、H2在一定条件下可以相互转化:CO(g)+H2O(g)![]() CO2(g)+H2(g)。在420℃时,平衡常数K=9。若反应开始时,CO、H2O的浓度均为0.1mol/L,则CO在此反应条件下的转化率为______________。
CO2(g)+H2(g)。在420℃时,平衡常数K=9。若反应开始时,CO、H2O的浓度均为0.1mol/L,则CO在此反应条件下的转化率为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式书写正确的是 ( )
A.在Ba(OH)2溶液中加入少量的硫酸氢钠溶液Ba2++2OH-+2H++SO![]() =BaSO4↓+2H2O
=BaSO4↓+2H2O
B.向次氯酸钙溶液中通入SO2气体Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.标准状况下,将112mLCl2缓慢通入10mL 1mol·L-1的FeBr2溶液中2Fe2++4Br-+3Cl2 =2Fe3++6Cl-+2Br2
D.向苯酚钠溶液中通入少量CO2气体![]() +CO2+H2O
+CO2+H2O![]()
![]() +HCO
+HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对已达化学平衡的反应 2X(g)+Y(g)![]() 2Z(g) ΔH<0 下列说法正确的是
2Z(g) ΔH<0 下列说法正确的是
A.减小压强,逆反应速率增大,正反应速率减小,平衡向逆方向移动
B.升高温度,正、逆反应速率均增大,平衡向逆方向移动
C.除去部分的Z,正反应速率增大,逆反应速率减小,平衡向正方向移动
D.加入正催化剂,正、逆反应速率均增大,平衡向正方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图![]() 为直流电源,
为直流电源,![]() 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,![]() 为电镀槽,接通电路后发现
为电镀槽,接通电路后发现![]() 上的c点显红色,为实现铁上镀锌,接通
上的c点显红色,为实现铁上镀锌,接通![]() 后,使c、d两点短路,下列叙述正确的是( )
后,使c、d两点短路,下列叙述正确的是( )

A. a为直流电源的负极
B. f电极为锌板
C. c极发生的反应为2H++2e-=H2↑
D. e极发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2![]() 中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应LiCoO2+C6
中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应LiCoO2+C6![]() CoO2+LiC6,下列说法正确的是 ( )
CoO2+LiC6,下列说法正确的是 ( )
A.充电时,电池的负极反应为LiC6-e-=Li+C6
B.放电时,电池的正极反应为CoO2+Li2++e-=LiCoO2
C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酒精灯加热下列溶液,蒸干后灼烧,所得固体质量最大的是( )
A. 20 mL 2 mol/L FeCl3溶液 B. 40 mL 1 mol/L NaHCO3溶液
C. 20 mL 1 mol/L Na2SO3溶液 D. 40 mL 2 mol/L NH4HCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) ![]() CO(g)+H2(g) ΔH=+131.3 kJmol-1。
CO(g)+H2(g) ΔH=+131.3 kJmol-1。
①该反应在常温下____________自发进行(填“能”与“不能”);
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是______________(填字母,下同)。
a.容器中的压强不变 b.1 mol H—H键断裂的同时断裂2 mol H—O键
c.c(CO)=c(H2) d.密闭容器的容积不再改变
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中以v(CO2) 表示的反应速率为________________ 。(取小数二位,下同)
②该反应为 _____(填“吸”或“放”)热反应,实验2条件下平衡常数K=________。
③若实验3达平衡时与实验2平衡状态中各物质的质量分数分别相等,且t<3min,则a、b应满足的关系是________________________(用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ,如图表示该反应进行过程中能量(单位为kJmol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c(CH3OH)增大的是___________。
CH3OH(g)+H2O(g) ,如图表示该反应进行过程中能量(单位为kJmol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c(CH3OH)增大的是___________。

a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加 入3mol Z,起始时容器体积均为V L,发生反应并达到平衡(X、Y状态未知):aX(?) +2Y(?)![]() 3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为 3:2:2,则下列说法一定正确的是( )
3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为 3:2:2,则下列说法一定正确的是( )
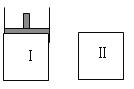
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时X的产率:Ⅰ>Ⅱ
C.若X、Y均为气态,则从起始到平衡所需时间:Ⅰ>Ⅱ
D.若X为固态,Y为气态,达平衡后若在Ⅱ中再加入1molZ,则新平衡时Z的体积分数变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com