
【题目】下列离子反应方程式书写正确的是 ( )
A.在Ba(OH)2溶液中加入少量的硫酸氢钠溶液Ba2++2OH-+2H++SO![]() =BaSO4↓+2H2O
=BaSO4↓+2H2O
B.向次氯酸钙溶液中通入SO2气体Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.标准状况下,将112mLCl2缓慢通入10mL 1mol·L-1的FeBr2溶液中2Fe2++4Br-+3Cl2 =2Fe3++6Cl-+2Br2
D.向苯酚钠溶液中通入少量CO2气体![]() +CO2+H2O
+CO2+H2O![]()
![]() +HCO
+HCO![]()
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是二元弱酸,NaHC2O4溶液呈酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系错误的是( )
A.V(NaOH) = 0时,c(H+) >1×10-7mol/L
B.V(NaOH)<10 mL时,可能存在c(Na+) = 2c(C2O42-)+c(HC2O4- )
C.V(NaOH) = 10 mL时,溶液的pH为9,则10-9= 10-5-2c(H2C2O4)-c(HC2O4-)
D.V(NaOH)>10 mL时,可能存在c(OH- )>c(Na+)>c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向某容积恒定的密闭容器中充入1 mol N2、3 mol H2,经充分反应后达到如下平衡:N2(g)+3H2(g)![]() 2NH3(g),下列有关说法中正确的是( )
2NH3(g),下列有关说法中正确的是( )
A. 达平衡后再加入一定量的N2,体系内各物质含量不变
B. N2、H2、NH3的浓度一定相等
C. 反应没有达到平衡时,NH3会不断地分解,达到平衡时则不会再分解
D. 平衡时,N2、H2物质的量之比为1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知维生素A的结构简式可写为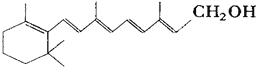 ,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来,关于它的叙述不正确的是( )
,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来,关于它的叙述不正确的是( )
A.维生素A的分子式为C20H30O
B.维生素A是一种易溶于水的醇
C.维生素A分子中有异戊二烯的碳链结构
D.1mol维生素A在催化剂作用下最多可与5molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是一些物质的熔沸点数据(常压):
钾 | 钠 | Na2CO3 | 金刚石 | 石墨 | |
熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
沸点(℃) | 774 | 882.9 | 1850(完全分解产生CO2) | --- | 4250 |
金属钠和CO2在常压、890℃发生如下反应:4Na(g)+3CO2(g) ![]() 2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
(1)上述反应的平衡常数表达式为________________;若4v正(Na)=3v逆(CO2),反应是否达到平衡________ (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min,金属钠的物质的量减少了0.2mol,则10min里CO2的平均反应速率为________________。
(3)高压下有利于金刚石的制备,理由_____________________________________________。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H= —357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(1)的热化学方程式:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的是离子组是( )
A.K+、Na+、![]() 、
、![]() B.Na+、
B.Na+、![]() 、Mg2+、ClO
、Mg2+、ClO
C.H+、Mg2+、![]() 、
、![]() D.Ag+、K+、
D.Ag+、K+、![]() 、Na+
、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A.氢氧化亚铁溶于稀硝酸中:Fe(OH)2 + 2H+ = Fe2+ + 2H2O
B.用惰性电极电解饱和食盐水:2Cl- + 2H2O![]() 2OH- + H2↑+ Cl2↑
2OH- + H2↑+ Cl2↑
C.湿润的醋酸铅试纸检验H2S气体的存在:Pb2+ + H2S = PbS + 2H+
D.在苯酚钠溶液中通入过量的CO2气体:2C6H5O- + CO2 + H2O → 2C6H5OH↓+ CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨、尿素[CO(NH2)2]都是氮的重要化合物,在工农业生产中应用广泛。
(1)已知:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92kJ·mol-1
2NH3(g)ΔH=-92kJ·mol-1
①取1molN2(g)和3molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量____92.2kJ(填“>”、“=”或“<”),原因是_______________。
②使用催化剂,该反应△H_____(填“变大”“变小”或“不变”)。
③已知:分别破坏1molN≡N键、1molH-H键需要吸收的能量为:946kJ、436kJ,则破坏1molN-H键需要吸收的能量为_____。
④当容积一定时,能判断该反应是否达到化学平衡状态的依据是_______________
a.容器中总压强不变 b.混合气体中c(CO)不变 c.v正(H2)=v逆(N2)
d.c(H2)=c(NH3) e. 混合气体密度不再变化 f.颜色不再变化
g. 混合气体平均相对分子质量不再变化
(2)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
Ⅰ.2NH3(g)+CO2(g)==NH2CO2NH4(s)△H=﹣159.5kJ/mol
Ⅱ.NH2CO2NH4(s)==CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
Ⅲ.H2O(l)==H2O(g)△H=+44.0kJ/mol
①写出CO2与NH3合成尿素和液态水的热化学反应方程式_______________________。
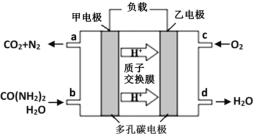
②化学家正在研究尿素动力燃料电池。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电,尿素燃料电池结构如图所示,回答下列问题:
电池中的负极为_____(填“甲”或“乙”),乙的电极反应式为_____________,电池工作时,理论上每净化1mol尿素,消耗O2的体积(标准状况下)约为_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则溶液中MgCl2与Al2(SO4)3的物质的量浓度之比为( )
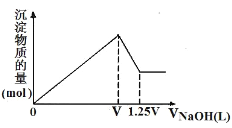
A.1:1B.1:2
C.3:2D.2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com