
【题目】以下是一些物质的熔沸点数据(常压):
钾 | 钠 | Na2CO3 | 金刚石 | 石墨 | |
熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
沸点(℃) | 774 | 882.9 | 1850(完全分解产生CO2) | --- | 4250 |
金属钠和CO2在常压、890℃发生如下反应:4Na(g)+3CO2(g) ![]() 2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
(1)上述反应的平衡常数表达式为________________;若4v正(Na)=3v逆(CO2),反应是否达到平衡________ (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min,金属钠的物质的量减少了0.2mol,则10min里CO2的平均反应速率为________________。
(3)高压下有利于金刚石的制备,理由_____________________________________________。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H= —357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(1)的热化学方程式:___________________________
【答案】:![]() 否 0.0015mol/(L·min)。 正反应是体积减小的可逆反应,增大压强,平衡向正反应方向移动,有利于金刚石的制备。 3Na 2O(s)+C(s,金刚石)=4Na(g)+Na2CO3(1) △H =-4.2 kJ/mol
否 0.0015mol/(L·min)。 正反应是体积减小的可逆反应,增大压强,平衡向正反应方向移动,有利于金刚石的制备。 3Na 2O(s)+C(s,金刚石)=4Na(g)+Na2CO3(1) △H =-4.2 kJ/mol
【解析】
根据方程式书写平衡常数表达式;根据化学反应化学反应速率计算公式求CO2的平均反应速率;根据影响化学平衡移动影响因素判断;根据盖斯定律书写热化学反应方程式。
(1)金属钠和CO2在常压、890℃发生如下反应:4Na(g)+3CO2(g) ![]() 2Na2CO3(1)+C(s,金刚石),该反应的平衡常数表达式为K=
2Na2CO3(1)+C(s,金刚石),该反应的平衡常数表达式为K=![]() 。若3v正(Na)=4v逆(CO2),该反应达到平衡状态,若4v正(Na)=3v逆(CO2),则该反应不能达到平衡状态;
。若3v正(Na)=4v逆(CO2),该反应达到平衡状态,若4v正(Na)=3v逆(CO2),则该反应不能达到平衡状态;
答案:![]() ;否;
;否;
(2)反应时间为10min,金属钠的物质的量减少了0.2mol,则根据方程式可知消耗CO2的物质的量是0.15mol,浓度是0.015mol/L,因此10min里CO2的平均反应速率为0.015mol/L÷10min=0.0015mol/(L·min);答案:0.0015mol/(L·min)。
(3)根据方程式4Na(g)+3CO2(g) ![]() 2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
可知,正反应是体积减小的可逆反应,因此增大压强,平衡向正反应方向移动,有利于金刚石的制备。答案:正反应是体积减小的可逆反应,增大压强,平衡向正反应方向移动,有利于金刚石的制备。
(4)根据反应①4Na(g)+3CO2(g) ![]() 2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
②CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石)△H=-357.5kJ/mol,则根据盖斯定律可知①-②![]() 3即得到6Na 2O(s)+2C(s,金刚石)=8Na(g)+2Na2CO3(1) △H =-8.4 kJ/mol,所以热化学方程式为:3Na 2O(s)+C(s,金刚石)=4Na(g)+Na2CO3(1) △H =-4.2 kJ/mol。
3即得到6Na 2O(s)+2C(s,金刚石)=8Na(g)+2Na2CO3(1) △H =-8.4 kJ/mol,所以热化学方程式为:3Na 2O(s)+C(s,金刚石)=4Na(g)+Na2CO3(1) △H =-4.2 kJ/mol。


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列反应中符合下列图像的是( )

A. N2(g)+3H2(g)![]() 2NH3(g) ΔH=-Q1kJ·mol-1(Q1>0)
2NH3(g) ΔH=-Q1kJ·mol-1(Q1>0)
B. 2SO3(g)![]() 2SO2(g)+O2(g) ΔH=+Q2kJ·mol-1(Q2>0)
2SO2(g)+O2(g) ΔH=+Q2kJ·mol-1(Q2>0)
C. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-Q3kJ·mol-1(Q3>0)
4NO(g)+6H2O(g) ΔH=-Q3kJ·mol-1(Q3>0)
D. H2(g)+CO(g)![]() C(s)+H2O(g) ΔH=+Q4kJ·mol-1(Q4>0)
C(s)+H2O(g) ΔH=+Q4kJ·mol-1(Q4>0)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为电解饱和食盐水的简单装置,下列有关说法正确的是( )
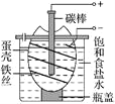
A.电解一段时间后,向蛋壳内的溶液中滴加几滴酚酞,呈红色
B.蛋壳表面缠绕的铁丝上发生氧化反应
C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种环境激素,存在如下转化关系:
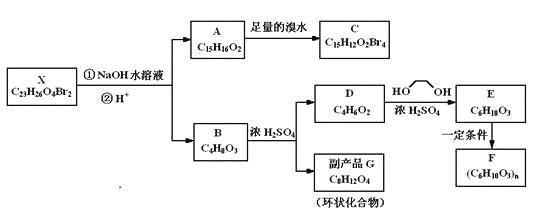
化合物A能与FeCl3溶液发生显色反应,分子中含有两个化学环境完全相同的甲基,其苯环上的一硝基取代物只有两种。1H-NMR谱显示化合物G的所有氢原子化学环境相同。F是一种可用于制备隐形眼镜的高聚物。
根据以上信息回答下列问题。
(1)下列叙述正确的是_________。
A.化合物A分子中含有联苯结构单元 |
B.化合物A可以和NaHCO3溶液反应,放出CO2气体 |
C.X与NaOH溶液反应,理论上1 mol X最多消耗6 mol NaOH |
D.化合物D能与Br2发生加成反应 |
(2)化合物C的结构简式是_________________,A→C的反应类型是________。
(3)写出同时满足下列条件的D的所有同分异构体的结构简式(不考虑立体异构_________。
a.属于酯类 b.能发生银镜反应
(4)写出B→C反应的化学方程式_______________________________________________。
(5)写出E→F反应的化学方程式_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联合制碱法中关键的一步是把NH4Cl从几乎饱和的NaHCO3溶液中分离出来,为此根据NaCl和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,可析出不夹带NaHCO3的NH4Cl。NaCl和NH4Cl共同存在时的溶解度曲线如图所示,以下操作正确的是( )
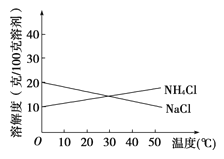
通入气体 | 温度控制 | |
A | CO2 | 30~40℃ |
B | CO2 | 0~10℃ |
C | NH3 | 30~40℃ |
D | NH3 | 0~10℃ |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式书写正确的是 ( )
A.在Ba(OH)2溶液中加入少量的硫酸氢钠溶液Ba2++2OH-+2H++SO![]() =BaSO4↓+2H2O
=BaSO4↓+2H2O
B.向次氯酸钙溶液中通入SO2气体Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.标准状况下,将112mLCl2缓慢通入10mL 1mol·L-1的FeBr2溶液中2Fe2++4Br-+3Cl2 =2Fe3++6Cl-+2Br2
D.向苯酚钠溶液中通入少量CO2气体![]() +CO2+H2O
+CO2+H2O![]()
![]() +HCO
+HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中,错误的是( )
A.NH4H是一种离子晶体,其中氢离子的核外电子排布与氦原子相同
B.在石墨晶体中,碳原子与共价键的个数比为2:3
C.三种氢化物的沸点高低:HBr>HCl>HF
D.甲基的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图![]() 为直流电源,
为直流电源,![]() 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,![]() 为电镀槽,接通电路后发现
为电镀槽,接通电路后发现![]() 上的c点显红色,为实现铁上镀锌,接通
上的c点显红色,为实现铁上镀锌,接通![]() 后,使c、d两点短路,下列叙述正确的是( )
后,使c、d两点短路,下列叙述正确的是( )

A. a为直流电源的负极
B. f电极为锌板
C. c极发生的反应为2H++2e-=H2↑
D. e极发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)在自然界中一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。从硫化物中提取单质锑一般先在高温下将硫化物转化为氧化物,再用碳还原:
①2Sb2S3+3O2+6Fe![]() Sb4O6+6FeS,
Sb4O6+6FeS,
②Sb4O6+6C![]() 4Sb+6CO↑。关于反应①、②的说法正确的是
4Sb+6CO↑。关于反应①、②的说法正确的是
A.反应①、②中的氧化剂分别是Sb2S3、Sb4O6
B.反应①中每生成3molFeS时,共转移6 mol电子
C.反应②说明高温下Sb的还原性比C强
D.每生成4 molSb时,反应①与反应②中还原剂的物质的量之比为2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com