
【题目】在一定条件下,固定容积的密闭容器中反应:2NO2(g)O2(g)+2NO(g) ΔH>0,达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是( )
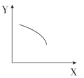
A.当X表示温度时,Y表示NO2的物质的量
B.当X表示压强时,Y表示NO2的百分含量
C.当X表示反应时间时,Y表示混合气体的密度
D.当X表示NO2的物质的量时,Y表示O2的物质的量
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应的实验,方法正确且能达到实验目的的是




A.图1、检验电流的方向B.图2、蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.图3、石油的分馏D.图4、分离CCl4萃取碘水后的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛矿工业中的酸性废水富含Ti、Fe等元素,其综合利用如图![]() 已知:
已知:![]() 易水解,只能存在于强酸性溶液中
易水解,只能存在于强酸性溶液中![]() :
:

(1)富含![]() 溶液中加入
溶液中加入![]() 粉末能得到固体
粉末能得到固体![]() ,其原理是______。
,其原理是______。
(2)制取![]() 发生的化学方程式为______;反应温度一般需控制在
发生的化学方程式为______;反应温度一般需控制在![]() 以下,其目的是______。
以下,其目的是______。
(3)已知![]() 。制取
。制取![]() 时,
时,![]() 达到溶解平衡时,若室温下测得溶液的pH为
达到溶解平衡时,若室温下测得溶液的pH为![]() ,
,![]() 。试判断所得的
。试判断所得的![]() 中______
中______![]() 填“有”或“没有”
填“有”或“没有”![]() ;煅烧中,为了得到较为纯净的
;煅烧中,为了得到较为纯净的![]() ,除了适当的温度外,还需要采取的措施是______。
,除了适当的温度外,还需要采取的措施是______。
(4)为了控制![]() 用量需要测定固体中
用量需要测定固体中![]() 的含量。称1g固体样品,用30mL蒸馏水溶解并加入
的含量。称1g固体样品,用30mL蒸馏水溶解并加入![]() 溶液和
溶液和![]() 溶液,再用
溶液,再用![]() 标准溶液滴定到溶液刚好变成粉红色,停止滴定,消耗标准溶液VmL。反应中涉及的重要化学方程式有:
标准溶液滴定到溶液刚好变成粉红色,停止滴定,消耗标准溶液VmL。反应中涉及的重要化学方程式有:
![]() 紫红
紫红![]() 粉红
粉红![]()
![]() 黄
黄![]() 无色
无色![]()
①![]() 的作用______。②样品中
的作用______。②样品中![]() 的含量为______
的含量为______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,属于水解反应的是( )
A.HS- + H2O![]() H3O+ + S2-B.CO2 + 2H2O
H3O+ + S2-B.CO2 + 2H2O![]() HCO3- + H3O+
HCO3- + H3O+
C.NH4++H2O![]() NH3H2O + H+D.HCO3- + OH-
NH3H2O + H+D.HCO3- + OH-![]() CO32- + H2O
CO32- + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含MgCl2、AlCl3均为nmol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是(离子(或物质)沉淀pH见表)
离子 | Mg2+ | Al3+ | 物质 | Al(OH)3 |
开始沉淀时的pH | 8.93 | 3.56 | 开始溶解时的pH | 8.04 |
完全沉淀时的pH | 10.92 | 4.89 | 完全溶解时的pH | 12.04 |
A. 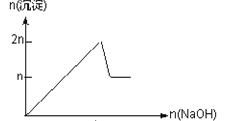
B. 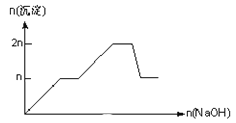
C. 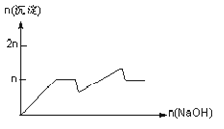
D. 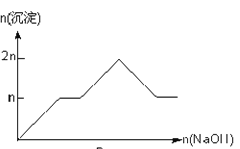
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验能力和创新意识是化学学科核心素养的重要内容之一。某研究性学习小组在验证反应“ Fe![]() ”的实验中检测到
”的实验中检测到![]() 发现和探究过程如下:向硝酸酸化的
发现和探究过程如下:向硝酸酸化的![]() 硝酸银溶液(
硝酸银溶液(![]() )中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物:
①检验上层清液中所含离子的方法:取上层清液,滴加_________,产生蓝色沉淀,说明溶液中含有Fe2+。
②经检验黑色固体为Ag,检验方法:取出少量黑色固体,洗涤后,加入适量稀硝酸使固体溶解,再滴加__________(填试剂),产生_________(填现象)。
(2)针对“溶液呈黄色”,甲认为溶液中有![]() 乙认为铁粉过量时不可能有
乙认为铁粉过量时不可能有![]() ,乙依据的原理是______。(用离子方程式表示)o
,乙依据的原理是______。(用离子方程式表示)o
针对这两种观点继续实验:取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
I | 3 | 产生大量白色沉淀;溶液呈红色 |
II | 30 | 产生白色沉淀,较3 min时量少;溶液红色较3 min时加深 |
III | 120 | 产生白色沉淀,较30min时量少;溶液红色较30min时变浅 |
(资料: ![]() -生成白色沉淀AgSCN)
-生成白色沉淀AgSCN)
(3)实验中溶液变为红色的离子方程式为_______________,产生白色沉淀说明存在___________(填离子符号)。
(4)对![]() 产生的原因做如下假设:
产生的原因做如下假设:
假设a:可能是铁粉表面有氧化层,能产生![]()
假设b:空气中存在![]() 发生反应
发生反应![]() 产生
产生![]()
假设c:酸性溶液中的NO3-将Fe2+氧化为Fe3+
假设d:溶液存在Ag+将Fe2+氧化为Fe3+
下述实验可证实假设a、b
①实验:向硝酸酸化的__________溶液( ![]() )中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液。3min 时溶液呈浅红色,30min后溶液几乎无色。
)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液。3min 时溶液呈浅红色,30min后溶液几乎无色。
②实验II的现象说明发生了反应__________(用离子方程式表示)。
(5)实验Ⅱ中发生的反应可以用下列装置来验证。其中甲溶液是___________,分别取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,_______ (“前者”或“后者”)红色更深。
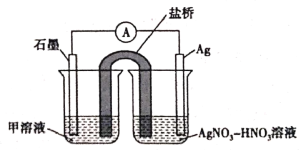
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①101kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1
③H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
④H2O(g)=H2O(l) ΔH=-44.0kJ·mol-1
下列结论正确的是( )
A.碳的燃烧热大于110.5kJ·mol-1
B.浓硫酸与稀NaOH溶液反应生成1mol水,放出57.3kJ 热量
C.氢气的燃烧热为241.8kJ·mol-1
D.2H2(g)+O2(g)=2H2O(l)的反应热为ΔH=571.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据环保要求,在处理有氰电镀废水时,剧毒的CN-离子在催化剂TiO2颗粒作用下,先用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用如图装置进行实验,测定CN-被处理的百分率。

现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出相关主要反应的离子方程式:甲中的反应_________________,乙中的反应:_____________________。
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。丙装置中的试剂是______________,丁装置的目的是________________________;干燥管Ⅱ的作用是______________________。
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比_____(填“偏高”或“偏低”),简述可能的原因:______________________。
(4)含氰废水也可采用电化学方法进行处理。在碱性条件下,使用惰性电极电解含氰废水,氰离子被氧化为无毒的物质,其中阳极电极反应式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 mL AgNO3和Ca(NO3)2的混合溶液中c(NO![]() )=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(Ca2+)为0.1 mol·L-1B.上述电解过程中共转移0.2 mol电子
C.电解得到的Ag的物质的量为0.1 molD.电解后溶液中c(H+)为0.2 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com