
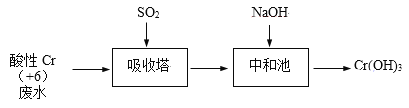
【题目】含+6价铬的废水毒性强,对环境污染严重。化工厂常用SO2处理含铬废水,其工艺流程如下图所示:
已知:Cr2O72- + H2O ![]() 2CrO42- + 2H+
2CrO42- + 2H+
(1)将吸收塔中1mol Cr2O72-与SO2反应的热化学方程式补全。
Cr2O72-(aq) + __SO2(g) + ___ ___ + ___ +___ ΔH = -1145 kJ/mol
(2)其他条件不变,研究吸收塔中pH对反应的影响。
pH | 2 | 4 | 6 |
Cr(+6) 最大去除率 | 99.99% 达排放标准 | 99.95% 达排放标准 | 99.5% 未达排放标准 |
时间 | 30 min | 35 min | 45 min |
①由上述数据获得的结论有________。
②实际工业生产控制pH = 4左右的原因是________。
③下列说法不合理的是________。
a.该酸性含铬废水中一定含有CrO42-,pH越大其含量越高
b.其他条件不变,增大压强,吸收塔中反应的K增大,有利于除去Cr(+6)
c.理论上看,SO32-、Fe2+等也可以用于除去Cr(+6)
(3)其他条件不变,研究温度对Cr(+6)去除率的影响(如图1所示)。
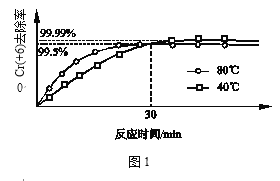
30min前相同时间内,80℃的Cr(+6)去除率比40℃高,30min后80℃的Cr(+6)去除率低,原因分别是_______;_______。
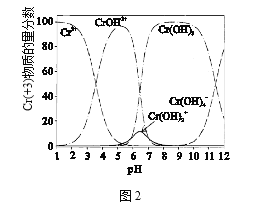
(4)图2为Cr(+3)微粒物质的量分数随溶液pH的变化关系示意图,中和池中应控制pH范围为_________。
(5)废水中Cr(+6)总浓度为a×10-3 mol/L,处理1000 L废水,去除率要求达到99.95%,理论上需要SO2物质的量为_________mol(写计算式)。
【答案】3 2H+(aq) 2Cr3+(aq) 3SO42-(aq) H2O(l) pH越大,Cr(+6)的去除率降低,反应速率越慢 与pH=2相比,pH=4时,Cr(+6)的去除率已达排放标准,控制pH=4左右可减少中和池中NaOH的用量,节约成本 b 30min前,Cr(+6)去除率主要由反应速率决定,温度高反应速率快,因此80℃的去除率更高 30min后,Cr(+6)去除率主要有反应限度决定,Cr2O72-与SO2的反应放热,温度越高,K越小,因此80℃的去除率比40℃低。 8~9.5左右 1.5a×99.95%
【解析】
Cr(+6)在酸性环境下主要以Cr2O72-形式存在,将具有强还原性的二氧化硫气体通入吸收塔与Cr(+6)发生氧化还原反应,将Cr(+6)降价生成Cr3+,中和池中加入NaOH使其生成氢氧化物沉淀除去。
(1)氧化还原反应离子方程式配平,利用得失电子数相等和原子守恒配平;热化学方程式书写注意注明状态;
(2)①根据表格可以得出随pH的增大Cr(+6)去除率的变化和去除所需时间。
②从速率、去除率、消耗原料几个角度综合分析;
③a.根据勒夏特例原理分析;b.k的变化只与温度有关;c.氧化还原角度分析;
(3)从速率和平衡两个角度分析;
(4)找出Cr(OH)3物质的量分数最大的pH范围即可;
(5)利用得失电子数相等进行计算。
(1)三步法配平:①根据化合价升降相等,配平化合价发生变化的元素②根据左右两边电荷守恒配平,酸性添加氢离子,碱性氢氧根离子 ③根据原子守恒配平添加水;热化学方程式书写注意注明状态,Cr2O72-(aq) + 3SO2(g) + 2H+(aq) 2Cr3+(aq) +3SO42-(aq)+H2O(l) ΔH = -1145 kJ/mol;
答案:3 2H+(aq) 2Cr3+(aq) 3SO42-(aq) H2O(l)
(2)①根据表格可以得出结论,随着pH的升高,Cr(+6)的去除率降低,反应速率变慢;
答案:pH越大,Cr(+6)的去除率降低,反应速率越慢
②实际工业生产应该从节省原料,条件易控角度分析,控制pH = 4左右的原因是Cr(+6)的去除率已达排放标准,控制pH=4左右可减少中和池中NaOH的用量,节约成本;
答案:Cr(+6)的去除率已达排放标准,控制pH=4左右可减少中和池中NaOH的用量,节约成本
③a.根据题干信息Cr2O72- + H2O ![]() 2CrO42- + 2H+,该酸性含铬废水中一定含有CrO42-,pH增大相当于减小氢离子浓度,平衡正向移动,CrO42-含量越高,故不选a;
2CrO42- + 2H+,该酸性含铬废水中一定含有CrO42-,pH增大相当于减小氢离子浓度,平衡正向移动,CrO42-含量越高,故不选a;
b.K的变化只与温度有关,压强无影响,故选b;
c.SO32-、Fe2+等也具有强还原性,可以与Cr(+6)发生氧化还原反应,用于除去Cr(+6),故不选c;
答案:b
(3)仔细观察图像可以发现前30min,80℃单位时间内去除率越高,反应速率越快;30min后去除率后面几乎不发生变化,说明达到了平衡,40℃时去除率要高,从平衡角度分析。
答案:30min前,Cr(+6)去除率主要由反应速率决定,温度高反应速率快,因此80℃的去除率更高;30min后,Cr(+6)去除率主要有反应限度决定,Cr2O72-与SO2的反应放热,温度越高,K越小,因此80℃的去除率比40℃低。
(4)Cr(+3)是以氢氧化铬沉淀形式除掉,所以根据图像选择氢氧化铬物质的量分数最大的pH范围;
答案:8~9.5左右
(5)利用氧化还原反应得失电子数相等列关系式可知
2Cr(+6) ~ 3SO2
2mol 3mol
a×10-3 mol/L×1000L×99.95% n(SO2)
计算得 n(SO2)=3mol×a×10-3 mol/L×1000L×99.95%/(2mol ) = 1.5a×99.95%mol;
答案:1.5a×99.95%


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】SO2、Na2S2O3、Na2S、Na2SO3等含硫化合物在工业上有广泛的用途。完成下列填空:
(1)硫原子核外电子排布式____,钠离子的核外有___种能量不同的电子。
(2)SO2分子构型为“V型”,则SO2是___(选填“极性”、“非极性”)分子,其在水中的溶解度比氯气___(选填“大”、“小”、“一样”)。
(3)棉织物用氯气漂白后,加入Na2S2O3除去余氯时,发生如下反应:___S2O32-+___Cl2+___H2O→___SO42-+___Cl-+___H+
配平该反应方程式,若反应中生成2molSO42-,则转移电子____mol。
(4)Na2S又称臭碱、硫化碱,用离子方程式说明Na2S溶液呈碱性的原因___。
(5)如图是Na2SO3溶液中各离子浓度的相对大小关系示意图。其中,②是___(填微粒符号)。在Na2SO3溶液中各微粒浓度等式关系正确的是____。
a.c(Na+)=c(SO32-)+2c(HSO3-)+2c(H2SO3)
b.c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)
c.c(OH-)=c(HSO3-)+c(H+)+c(H2SO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,工业上由铬铁矿(主要成分为FeOCr2O3、SiO2等)制备,制备流程如图所示:
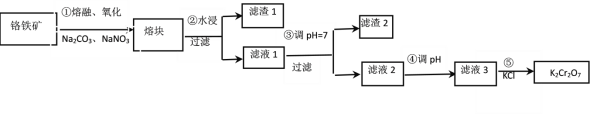
已知:a.步骤①的主要反应为:2FeOCr2O3+4Na2CO3+ 7NaNO3 ![]() 4Na2CrO4+Fe2O3+4CO2+7NaNO2,b. 2CrO42-+2H+
4Na2CrO4+Fe2O3+4CO2+7NaNO2,b. 2CrO42-+2H+ ![]() Cr2O72-+H2O,下列说法正确的是
Cr2O72-+H2O,下列说法正确的是
A. 步骤①熔融、氧化可以在陶瓷容器中进行
B. 步骤①中每生成44.8L CO2共转移7mol电子
C. 步骤④若调节滤液2的pH使之变小,则有利于生成Cr2O72—
D. 步骤⑤生成K2Cr2O7晶体,说明该温度下K2Cr2O7溶解度小于Na2Cr2O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充满等物质的量的甲、乙两种气体,它们的温度和摩尔质量均相同。试根据甲、乙的密度(ρ)的关系,下列说法中正确的是
A. 若ρ(甲)>ρ(乙),则气体体积:甲<乙
B. 若ρ(甲)>ρ(乙),则分子数:甲>乙
C. 若ρ(甲)<ρ(乙),则气体摩尔体积:甲<乙
D. 若ρ(甲)<ρ(乙),则气体的压强:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 2H2S+SO2=3S↓+2H2O中,氧化产物和还原产物物质的量之比为2:1
B. 4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O中,氧化剂和还原剂物质的量之比为5:2
C. 3I2+6KOH![]() 5KI+KIO3+3H2O中,被氧化和被还原的碘原子物质的量之比为1:5
5KI+KIO3+3H2O中,被氧化和被还原的碘原子物质的量之比为1:5
D. 2FeS+6H2SO4(浓)![]() Fe2(SO4)3+3SO2↑+2S↓+6H2O中,发生氧化反应和发生还原反应的硫原子物质的量之比为2:3
Fe2(SO4)3+3SO2↑+2S↓+6H2O中,发生氧化反应和发生还原反应的硫原子物质的量之比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚碳酸酯(简称PC)是重要的工程塑料,某种PC塑料(N)的合成路线如下:
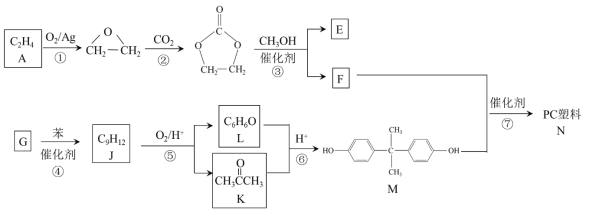
已知:
i.R1COOR2 + R3OH![]() R1COOR3 + R2OH
R1COOR3 + R2OH
ii.R1CH=CHR2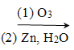 R1CHO + R2CHO
R1CHO + R2CHO
(1)A 中含有的官能团名称是______。
(2)①、②的反应类型分别是______、______。
(3)③的化学方程式是______。
(4)④是加成反应,G的核磁共振氢谱有三种峰,G的结构简式是______。
(5)⑥中还有可能生成的有机物是______(写出一种结构简式即可)。
(6)⑦的化学方程式是______。
(7)己二醛是合成其他有机物的原料。L经过两步转化,可以制备己二醛。合成路线如下:

中间产物1的结构简式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是0.01 mol/L甲溶液滴定0.01 mol/L乙溶液的导电能力变化曲线,其中曲线③是盐酸滴定NaAc溶液,其他曲线是醋酸滴定NaOH溶液或者NaOH溶液滴定盐酸。下列判断错误的是
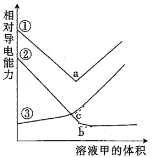
A.条件相同时导电能力:盐酸>NaAc
B.曲线①是NaOH溶液滴定盐酸导电能力变化曲线
C.随着甲溶液体积增大,曲线①仍然保持最高导电能力
D.a点是反应终点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为周期表前20号元素中某些元素的有关数据:
元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
原子半径(10-10m) | 1.86 | 1.52 | 0.66 | 0.53 | 0.77 | 1.10 | 0.99 | 2.31 | 0.70 |
最高价态 | +1 | +1 | —— | +1 | +4 | +5 | +7 | +1 | +5 |
最低价态 | —— | —— | -2 | -1 | -4 | -3 | -1 | —— | -3 |
试回答下列问题:(用对应具体符号或名称表示)
(1)以上9种元素的原子中,还原性最强的是________(名称),写出它的原子结构示意图:___________________ ;
(2)③与④可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:________________________________________(分解反应)。
(3)某元素R的原子半径为1.04×10-10m,该元素在周期表中的位置是_______________
(4)①、③、⑦三种元素形成的离子,其半径由小到大的顺序为_______________
(5)下列事实能说明元素⑦的非金属性比硫元素的非金属性强的是___________。
a.元素⑦形成的单质比硫元素形成的单质的熔点低
b.元素⑦和硫两元素的简单氢化物受热分解,前者的分解温度高
c.元素⑦的单质通入到H2S的溶液中出现浑浊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com