
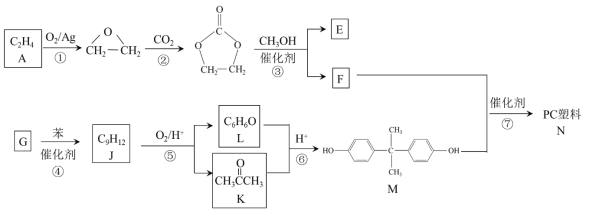
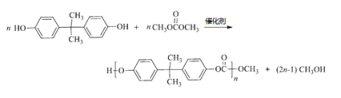
����Ŀ����̼���������PC������Ҫ�Ĺ������ϣ�ij��PC����(N)�ĺϳ�·�����£�
��֪��
i��R1COOR2 + R3OH![]() R1COOR3 + R2OH
R1COOR3 + R2OH
ii��R1CH=CHR2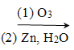 R1CHO + R2CHO
R1CHO + R2CHO
��1��A �к��еĹ�����������______��
��2���١��ڵķ�Ӧ���ͷֱ���______��______��
��3���۵Ļ�ѧ����ʽ��______��
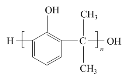
��4�����Ǽӳɷ�Ӧ��G�ĺ˴Ź������������ַ壬G�Ľṹ��ʽ��______��
��5�����л��п������ɵ��л�����______��д��һ�ֽṹ��ʽ���ɣ���
��6���ߵĻ�ѧ����ʽ��______��
��7������ȩ�Ǻϳ������л����ԭ�ϡ�L��������ת���������Ʊ�����ȩ���ϳ�·�����£�

�м����1�Ľṹ��ʽ��______��
���𰸡�̼̼˫�� ������Ӧ �ӳɷ�Ӧ  CH3CH=CH2
CH3CH=CH2 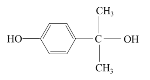 ��
�� ��
��
![]()
��������
A�ķ���ʽΪC2H4��ӦΪCH2=CH2������������Ӧ���ɻ������飬��������Ͷ�����̼��Ӧ����̼���Ҷ�����̼���Ҷ����ͼ״�������Ϣi�еķ�Ӧ����̼���������HOCH2CH2OH������F��M������N����EΪHOCH2CH2OH��FΪ̼����������ṹ��ʽΪ![]() ��
��
G�ͱ���Ӧ����J����J����ʽ֪G����J�ķ�ӦΪ�ӳɷ�Ӧ��GΪCH2=CHCH3��J����������ӦȻ���ữ����L�ͱ�ͪ��L�ͱ�ͪ�����������·�Ӧ����M����M�ṹ��ʽ��D����ʽ֪��DΪ![]() ��F��M�������۷�Ӧ���ɵ�PC�ṹ��ʽΪ
��F��M�������۷�Ӧ���ɵ�PC�ṹ��ʽΪ![]() ��
��
��7������Ϣii��֪�����Ƽ���ȩ��ͨ������ϩ�������õ�������̼̼˫����ͨ������±��������ȥ�õ���
��1��A�ķ���ʽΪC2H4��ӦΪCH2=CH2�����еĹ�����������̼̼˫����
��2����Ӧ������ϩ���������ɻ������飬��Ӧ����Ϊ������Ӧ����Ӧ���ǻ���������CO2�����ӳɷ�Ӧ����![]() ����Ӧ�����Ǽӳɷ�Ӧ��
����Ӧ�����Ǽӳɷ�Ӧ��
��3����Ӧ����![]() ��CH3OH����ȡ����Ӧ�������Ҷ�����̼���������������Ӧ�Ļ�ѧ����ʽ��
��CH3OH����ȡ����Ӧ�������Ҷ�����̼���������������Ӧ�Ļ�ѧ����ʽ�� ��
��
��4����Ӧ����G�ͱ������ӳɷ�Ӧ���ɵ�JΪC9H12����ԭ���غ��֪D�ķ���ʽΪC3H6�����G�ĺ˴Ź������������ַ壬G�Ľṹ��ʽ��CH3CH=CH2��
��5����Ӧ���б��Ӻͱ�ͪ�������ӳɷ�Ӧ����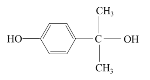 �������Է������۷�Ӧ����
�������Է������۷�Ӧ����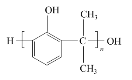 �ȣ�
�ȣ�
��6����Ӧ����̼���������![]() �������۷�Ӧ����PC���ϵĻ�ѧ����ʽΪ
�������۷�Ӧ����PC���ϵĻ�ѧ����ʽΪ![]() ��
��
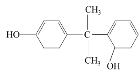
��7������Ϣii��֪�����Ƽ���ȩ��ͨ������ϩ�������õ�������̼̼˫����ͨ������±��������ȥ�õ������LΪ���ӿ�֪���ϳ�·��Ϊ������H2�ӳ����ɻ�������������������ȥ��Ӧ���ɻ���ϩ������ٴ��������ü���ȩ���ɴ˿�֪�м����1Ϊ���������ṹ��ʽ��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊȷ��Na2CO3��NaHCO3�������Ʒ����ɣ���ȡ�ķݸ���Ʒ����ˮ��ֱ���μ�����ͬŨ������60.0mL����ַ�Ӧ������CO2�����(������ɱ�״���µ������������CO2��ˮ�е��ܽ�)���±���
ʵ����� | I | II | III | IV |
�������(mL) | 60.0 | 60.0 | 60.0 | 60.0 |
��Ʒ����(g) | 2.96 | 3.70 | 5.18 | 6.66 |
CO2���(mL) | 672 | 840 | 896 | 672 |
��1����Ʒ�����ʵ���֮��n(NaHCO3)��n(Na2CO3)=___��
��2����������ʵ���Ũ��c(HCl)=___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ķ�չ�����У�����������Ҫ�����á�
��1�������йؽ������ʵ�������ȷ����_______��
A.�����Ʒdz����ã���ʵ�����б�����ʯ���ͻ�ú����
B.������ǯ��סһС���������ھƾ����ϼ��ȣ��ɹ۲쵽�����ۻ����������������
C.��������ˮ������Ӧ�Ļ�ѧ����ʽΪ2Fe+3H2O(g)=Fe2O3+3H2
��2����NaOH��MgCl2��AlCl3���ֹ�����ɵĻ������������ˮ����1.16 g��ɫ�����������õ���Һ����μ���1 mol��L��1 HCl��Һ������HCl��Һ����������ɳ�����������ϵ����ͼ��ʾ���Իش�
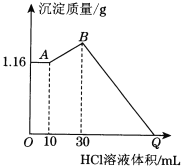
��A��ij�����Ļ�ѧʽΪ________��B��ij�����Ļ�ѧʽΪ________________________��д��A��B�η�����Ӧ�����ӷ���ʽ_____________________________��
��ԭ�������MgCl2��������________g��AlCl3��������________g��NaOH��������________g��
��Q��HCl��Һ��������________mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fe3O4�к���![]() ��
��![]() ���ֱ��ʾΪFe����Fe������Fe3O4/PdΪ�����ϣ���ʵ����H2�������Է�ˮ�е��°���NO2�����䷴Ӧ����ʾ��ͼ��ͼ��ʾ������˵������ȷ����
���ֱ��ʾΪFe����Fe������Fe3O4/PdΪ�����ϣ���ʵ����H2�������Է�ˮ�е��°���NO2�����䷴Ӧ����ʾ��ͼ��ͼ��ʾ������˵������ȷ����

A. Pd�Ϸ����ĵ缫��ӦΪ��H2 - 2e�� 2H��
B. Fe������Fe�����ת�����˴��ݵ��ӵ�����
C. ��Ӧ������NO2����Fe����ԭΪN2
D. �ø÷�������ˮ���pH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����+6�۸��ķ�ˮ����ǿ���Ի�����Ⱦ���ء�����������SO2����������ˮ���乤����������ͼ��ʾ��
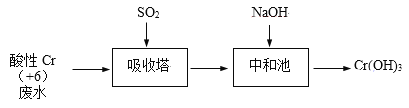
��֪��Cr2O72- + H2O ![]() 2CrO42- + 2H+
2CrO42- + 2H+
��1������������1mol Cr2O72-��SO2��Ӧ���Ȼ�ѧ����ʽ��ȫ��
Cr2O72-(aq) + __SO2(g) + ___ ___ + ___ +___ ��H = -1145 kJ/mol
��2�������������䣬�о���������pH�Է�Ӧ��Ӱ�졣
pH | 2 | 4 | 6 |
Cr��+6�� ���ȥ���� | 99.99% ���ŷű� | 99.95% ���ŷű� | 99.5% δ���ŷű� |
ʱ�� | 30 min | 35 min | 45 min |
�����������ݻ�õ�������________��
��ʵ�ʹ�ҵ��������pH = 4���ҵ�ԭ����________��
������˵������������________��
a.�����Ժ�����ˮ��һ������CrO42-��pHԽ���京��Խ��
b.�����������䣬����ѹǿ���������з�Ӧ��K���������ڳ�ȥCr��+6��
c.�����Ͽ���SO32-��Fe2+��Ҳ�������ڳ�ȥCr��+6��
��3�������������䣬�о��¶ȶ�Cr��+6��ȥ���ʵ�Ӱ�죨��ͼ1��ʾ����
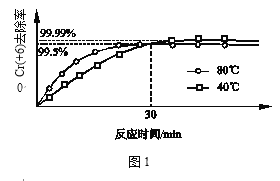
30minǰ��ͬʱ���ڣ�80���Cr��+6��ȥ���ʱ�40��ߣ�30min��80���Cr��+6��ȥ���ʵͣ�ԭ��ֱ���_______��_______��
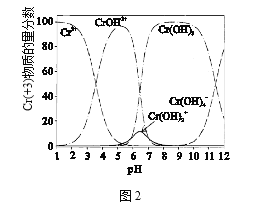
��4��ͼ2ΪCr��+3�������ʵ�����������ҺpH�ı仯��ϵʾ��ͼ���кͳ���Ӧ����pH��ΧΪ_________��
��5����ˮ��Cr��+6����Ũ��Ϊa��10-3 mol/L������1000 L��ˮ��ȥ����Ҫ��ﵽ99.95%����������ҪSO2���ʵ���Ϊ_________mol��д����ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ֵ���ϳɰ���װ����ͼ��ʾ����װ�ù���ʱ������˵����ȷ����
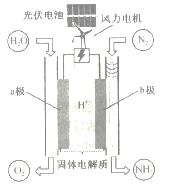
A. ͼ���漰������ת����ʽ����3��
B. ������������������ʵ���֮����1:1
C. ��·��ÿͨ��1mol���ӣ���1mol H+Ǩ����a��
D. b���Ϸ�������Ҫ��ӦΪN2+6H++6e-=2NH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(CrN)��һ�����õ���ĥ���ϣ�ʵ���ҿ�����ˮ�Ȼ���(CrCl3)�백���ڸ����·�Ӧ�Ʊ�����Ӧԭ��ΪCrCl3+NH3![]() CrN+3HCl.�ش��������⣺
CrN+3HCl.�ش��������⣺
(1)�Ʊ���ˮ�Ȼ������Ȼ����к�ǿ����ˮ�ԣ�ͨ�����Ȼ�������(CrCl3��6H2O)����ʽ���ڡ�ֱ�Ӽ�����ˮ�����õ�Cr2O3���йط�Ӧ�Ļ�ѧ����ʽΪ______________�����Ȼ��������Ʊ���ˮ�Ȼ����ķ�����_____________________________��
(2)�Ʊ���������ijʵ��С������Ʊ���������װ������ͼ��ʾ(�г������װ��ʡ��)��
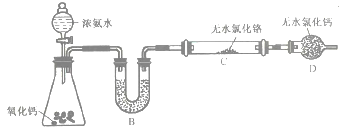
��װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ_____________________��
��ʵ�鿪ʼʱ��Ҫ�ȴ�װ��A�л����������װ��C��Ŀ����___________________��
��װ��B��ʢ�ŵ��Լ���____________��װ��D��������_____________________��
����ͬѧ��Ϊ��װ����һ��ȱ�ݣ���ȱ����_______________________��
(3)�Ȼ����Ĵ��Ȳⶨ���Ƶõ�CrN�к���Cr2N���ʣ�ȡ��Ʒ14.38g�ڿ����г�ּ��ȣ��ù������(Cr2O3)������Ϊ16.72g������Ʒ��CrN����������Ϊ_____________(�������3λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������ѧ�û�ѧ֪ʶ����Ҫ�����������йػ�ѧ�����ʾ��ȷ���У� ��
���õ���ʽ��ʾHCl���γɹ��̣�![]()
��MgCl2�ĵ���ʽ��![]() ��������Ϊ133��������Ϊ78���ԭ�ӣ�
��������Ϊ133��������Ϊ78���ԭ�ӣ�![]() Cs
Cs
����ϩ���Ҵ��ṹ��ʽ����Ϊ��CH2=CH2��C2H6O ��S2���Ľṹʾ��ͼ��![]()
��������ӵĽṹʽ��H-O-Cl ��CO2�ķ���ģ��ʾ��ͼ:![]()
A. 3�� B. 4�� C. 5�� D. 6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ijЩ�л���֮����ת�����Դ���̫���ܣ���ԭ����Ƭ��ϩ(NBD)����̫������ת����Ϊ�Ļ���(Q)����֪�� ��C7H8(l)(NBD)��9O2(g)=7CO2(g)��4H2O(l)����H1����C7H8(l)(Q)��9O2(g)=7CO2(g)��4H2O(l)����H2����
![]()
![]() ����H��+88.62 kJ��mol��1��������������ȷ����(����)
����H��+88.62 kJ��mol��1��������������ȷ����(����)
A. ��H1>��H2 B. NBD��������Q��������
C. NBD��Q�ȶ� D. NBDת��ΪQ�����ȷ�Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com