
部分中学化学常见元素原子结构及性质如表所示:
| 序号 | 元素 | 结构及性质 |
| ① | A | A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5 |
| ② | B | B原子最外层电子数是内层电子总数的 |
| ③ | C | C是常见化肥的主要元素,单质常温下呈气态 |
| ④ | D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| ⑤ | E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 |
| ⑥ | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
科目:高中化学 来源: 题型:填空题
I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等。按要求回答下列问题:
(1)写出X的原子结构示意图_______________。
(2)列举一个事实说明W非金属性强于Z: _______________(用化学方程式表示)。
(3)含Y的某种盐常用作净水剂,其净水原理是__________(用离子方程式表示)。
II.运用所学化学原理,解决下列问题:
(4)已知:Si+2NaOH+H2O=Na2SiO3+2H2。某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为_________________。
(5)已知:①C(s)+ O2(g)=CO2(g)  H=a kJ· mol-1;②CO2(g) +C(s)=2CO(g)
H=a kJ· mol-1;②CO2(g) +C(s)=2CO(g)  H=b kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)
H=b kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)  H=c kJ· mol-1。工业上生产粗硅的热化学方程式为____________。
H=c kJ· mol-1。工业上生产粗硅的热化学方程式为____________。
(6)已知:CO(g)+H2O(g) H2(g) + CO2(g)。右表为该反应在不同温度时的平衡常数。则:该反应的
H2(g) + CO2(g)。右表为该反应在不同温度时的平衡常数。则:该反应的 H________0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为_________。
H________0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期元素X、Y、Z、L、M、Q的原子半径和主要化合价见下表
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +4、-4 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图所示为血红蛋白和肌红蛋白的活性部分——血红素的结构式。
回答下列问题:
(1)血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大的顺序是 ,写出基态Fe原子的核外电子排布式: 。 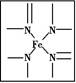
(2)血红素中N原子的杂化方式为 ,在如图的方框内用“→”标出Fe2+的配位键。
(3)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 。 
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
(1)L的元素符号为________;M在元素周期表中的位置为________;五种元素的原子半径从大到小的顺序是________(用元素符号表示)。
(2)Z、X两元素按原子数目比1∶3和2∶4构成分子A和B,A的电子式为________,B的结构式为________。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物化学式为________,该族二~五周期元素单质分别与H2反应生成1 mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是________(填字母代号)。
a.+99.7 kJ·mol-1 b.+29.7 kJ·mol-1
c.-20.6 kJ·mol-1 d.-241.8 kJ·mol-1
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。写出阳极生成R的电极反应式:_________________________;由R生成Q的化学方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E五种短周期元素,已知:
①原子半径递增顺序为:A、D、C、B、E
②短周期(除稀有气体元素外)所有元素中A的原子半径与E的原子半径之比为最小
③B、C、D三种元素电子层相同,三者原子序数之和为21,且D原子次外层电子数为最外层电子数的,
请回答下列问题:
(1)写出E单质在D单质中燃烧产物的电子式: 。
(2)C2A4·H2O与NH3·H2O相似,水溶液也呈弱碱性,用电离方程式表示其水溶液呈弱碱性的原因: 。
(3)B、D、E三种元素可组成常见化合物X,A、B、D、E可组成常见化合物Y,X、Y均是生活中常见的化学试剂,它们在一定条件下可互相转化。当a mol Y转化成a mol X时:(溶液中进行)
①若加入a mol纯净物Z就可实现转化,则加入Z为 (填一种Z物质化学式)。
②若加入0.5a mol纯净物Z就可实现转化,则加入Z为 (填一种Z物质化学式)。
(4)C2A4可用作高能燃料电池的燃料,生成物之一为C的单质,惰性材料作电极,KOH作电解质溶液构成原电池,写出负极的电极反应: ;用该电池电解过量CuSO4溶液,共收集到3.36 L(标准状况)的气体,电池消耗6.4 g C2A4,则该燃料的利用率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相 关 信 息 |
| X | X最高价氧化物的水化物与气态氢化物可以形成一种盐 |
| Y | 单质是良好的半导体材料,广泛应用于光电信息领域 |
| Z | Z的一种核素质量数为27,中子数为14 |
| W | 最高价氧化物对应的水化物是一种不溶于水的蓝色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
a、b、c、d、e、f、g为七种由短期周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com